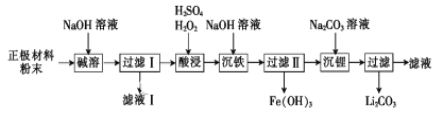
题目内容
【题目】现使用酸碱中和滴定法测定市售白醋的总酸量g/100ml![]() 。
。
(1)量取10.00ml食用白醋,在烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得待测白醋溶液。
(2)用___(填仪器名称)取待测白醋溶液20.00ml于锥形瓶中,向其中滴加2滴酚酞。
(3)读取盛装0.1000mol/LNaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为___mL。滴定终点的现象:___,停止滴定,记录NaOH溶液的终读数,计算实验所用NaOH溶液总体积记录于下表,重复滴定4次。
![]()
(4)实验记录数据(ml)
滴定次数 | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH) | 15.95 | 15.00 | 15.05 | 14.95 |
(5)数据处理与讨论:
A.甲同学在处理数据时计算得:平均消耗的NaOH溶液的体积__ml,按正确数据处理,可得市售白醋总酸量![]() __g/100ml。
__g/100ml。
B.在本实验的滴定过程中,下列操作对实验结果的影响是(填写“偏大”、“偏小”或“无影响”)。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗___;
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失___;
c.锥形瓶中加入待测白醋溶液后,再加少量水___。
【答案】酸式滴定管 0.70 当滴入最后一滴氢氧化钠溶液时,溶液的颜色由无色变为红色,且半分钟颜色不恢复 15.00 4.5 偏大 偏大 无影响
【解析】
(2)用酸式滴定管(或10mL移液管)量取10.00mL食用白醋,故答案为:酸式滴定管;
(3)滴定管液面的读数0.70mL,NaOH滴定食醋的终点为:当滴入最后一滴氢氧化钠溶液时,溶液的颜色由无色变为红色,且半分钟颜色不恢复,故答案为:0.70,当滴入最后一滴氢氧化钠溶液时,溶液的颜色由无色变为红色,且半分钟颜色不恢复;
(5)A.第1次滴定误差明显大,属异常值,应舍去;3次消耗的NaOH溶液的体积为:15.00mL;15.05mL;14.95mL;则NaOH溶液的体积的平均值为15.00mL;
设10mL市售白醋样品含有 CH3COOH Xg,则
CH3COOH~NaOH
60 40
Xg×0.2 0.1000mol/L×0.015L×40g/mol
X=0.450
样品总酸量为0.450×![]() =4.50g/100mL,
=4.50g/100mL,
故答案为:15.00,4.5,
B.a.碱式滴定管在滴定时未用标准NaOH溶液润洗,标准液浓度降低,造成V(标准)偏大,根据c(待测)=![]() 分析可知c(待测)偏大。
分析可知c(待测)偏大。
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=![]() 分析可知c(待测)偏大。
分析可知c(待测)偏大。
c.锥形瓶中加入待测白醋溶液后,再加少量水,对V(标准)无影响,根据c(待测)=![]() 分析可知c(待测)不变,故对实验结果无影响。故答案为:偏大,偏大,无影响。
分析可知c(待测)不变,故对实验结果无影响。故答案为:偏大,偏大,无影响。

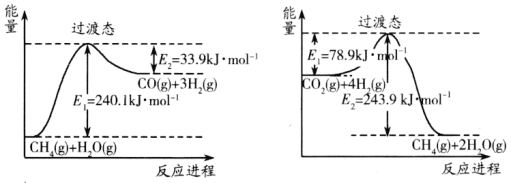
【题目】(1)12g碳与适量水蒸气反应生成CO和H2,需吸收131.3KJ热量,此反应的热化学方程式为______________________________。
(2)已知以下的热化学反应方程式:
①2CO(g)+O2(g)=2CO2(g) △H=-566kJ/mol
②2H2(g)+O2(g)=2H2O(g) △H=-484kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890kJ/mol
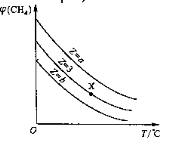
则:CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=______。
(3)已知H2(g)+Br2(l)=2HBr(g) △H=-102kJ/mol,其他的相关数据如下表:
H2(g) | Br2(l) | HBr(g) | |
1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | a | 369 |
则表中a为_______。