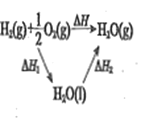题目内容
【题目】能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)在25 ℃、101 kPa时,16 g CH4完全燃烧生成液态水时放出的热量是890.31 kJ,则表示CH4燃烧热的热化学方程式是_______________________。
(2)已知:C(s) + O2(g)![]() CO2(g) ΔH1 =-437.3 kJmol-1
CO2(g) ΔH1 =-437.3 kJmol-1
2H2(g) + O2(g) ![]() 2H2O(g) ΔH2 =-571.6 kJmol-1
2H2O(g) ΔH2 =-571.6 kJmol-1
2CO(g) +O2(g)![]() 2CO2(g) ΔH3 =-566.0 kJmol-1
2CO2(g) ΔH3 =-566.0 kJmol-1
则煤气化主要反应的热化学方程式是:C(s)+ H2O(g)![]() CO(g) + H2(g) ΔH =________kJmol-1。如果该反应ΔS =+133.7 J·mol-1·K-1 ,该反应在常温下 _______自发进行(填 “能”或“不能”)。
CO(g) + H2(g) ΔH =________kJmol-1。如果该反应ΔS =+133.7 J·mol-1·K-1 ,该反应在常温下 _______自发进行(填 “能”或“不能”)。
(3) 已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则反应N2(g)+3H2(g) ![]() 2NH3 (g) ΔH =_________
2NH3 (g) ΔH =_________
【答案】CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) ΔH =-890.31 KJmol-1 +131.5 不能 -92 KJ/mol
【解析】
(1)燃烧热为1mol可燃物完全燃烧生成稳定的氧化物时释放的热量;
(2)根据盖斯定律及G=H-TS进行判断;
(3)旧键的断裂吸收热量,新键的形成释放热量。
(1)燃烧热为1mol可燃物完全燃烧生成稳定的氧化物时释放的热量,16 g CH4即1mol,完全燃烧生成液态水时放出的热量是890.31 kJ,则CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) ΔH =-890.31 KJmol-1;
(2)①C(s) + O2(g)![]() CO2(g) ΔH1 =-437.3 kJmol-1;②2H2(g) + O2(g)
CO2(g) ΔH1 =-437.3 kJmol-1;②2H2(g) + O2(g) ![]() 2H2O(g) ΔH2 =-571.6 kJmol-1;③2CO(g) +O2(g)
2H2O(g) ΔH2 =-571.6 kJmol-1;③2CO(g) +O2(g)![]() 2CO2(g) ΔH3 =-566.0 kJmol-1,根据盖斯定律,①-
2CO2(g) ΔH3 =-566.0 kJmol-1,根据盖斯定律,①-![]() ×②-
×②-![]() ×③可得C(s)+ H2O(g)
×③可得C(s)+ H2O(g)![]() CO(g) + H2(g),则 ΔH=-437.3 kJmol-1+
CO(g) + H2(g),则 ΔH=-437.3 kJmol-1+![]() ×571.6 kJmol-1+
×571.6 kJmol-1+![]() ×566.0 kJmol-1=+131.5 kJmol-1;G=H-TS,G<0时,可自发进行,该反应S>0,H>0,则常温时不能自发进行;
×566.0 kJmol-1=+131.5 kJmol-1;G=H-TS,G<0时,可自发进行,该反应S>0,H>0,则常温时不能自发进行;
(3)旧键的断裂吸收热量,新键的形成释放热量,根据方程ΔH=436kJ×3+946kJ-391kJ×6=-92 kJ/mol。

 名校课堂系列答案
名校课堂系列答案【题目】甲醇是重要的化学工业基础原料和液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度(℃) | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+ CO2(g) | K3 | ||
(1)反应②是___________(填“吸热”或“放热”)反应。
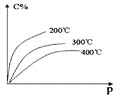
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图所示。则平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。

(3)判断反应③△H______0; △S______0(填“>”“=”或“<”)在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、 CH3OH、H2O的物质的量分别为6mol、2 mol、10 mol、10 mol,此时v(正)_____v(逆)(填“>”“=”或“<”)
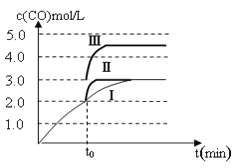
(4)一定温度下,在3 L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是________________。
【题目】在2L密闭容器内,800℃时,加入一定量的NO、O2,发生如下反应:2NO(g)+O2(g) ![]() 2NO2(g) ΔH< 0,反应过程中n(NO)随时间的变化如下表:
2NO2(g) ΔH< 0,反应过程中n(NO)随时间的变化如下表:
时间/s | 0 | 10 | 20 | 30 | 40 | 50 |
n(NO)/mol | 0. 20 | 0. 10 | 0.08 | 0.07 | 0.07 | 0.07 |
(1)计算该反应在20秒内用O2表示的反应速率v(O2)= ______________ ;
(2)写出该反应的平衡常数表达式____________。升高温度该反应平衡常数会_______(填“增大”“减小”或“不变”)
(3)下列示意图正确且能说明反应达到平衡状态的是___________

(4)能使该反应的反应速率增大,且NO的平衡转化率也增大的是__________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
(5)已知:2NO(g)![]() N2(g)+O2(g) K1=1×1030;2CO2(g)
N2(g)+O2(g) K1=1×1030;2CO2(g)![]() 2CO(g)+O2(g)K2= 4×10-92。随着轿车进入家庭,汽车尾气(含碳氢化合物、一氧化碳、二氧化硫、一氧化氮等物质)污染成为备受关注的环境问题,某市政府要求全市新有汽车尾气处理装置完成改装,改装后的尾气处理装置主要是加了有效催化剂。请你根据以上有关数据回答:
2CO(g)+O2(g)K2= 4×10-92。随着轿车进入家庭,汽车尾气(含碳氢化合物、一氧化碳、二氧化硫、一氧化氮等物质)污染成为备受关注的环境问题,某市政府要求全市新有汽车尾气处理装置完成改装,改装后的尾气处理装置主要是加了有效催化剂。请你根据以上有关数据回答:
①2NO(g)+2CO(g) ![]() N2(g)+ 2CO2(g) K=_____________
N2(g)+ 2CO2(g) K=_____________
②仅使用催化剂_______(填“能”或“否”)消除NO、CO污染气体。
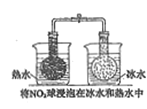
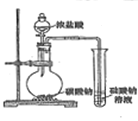
【题目】下列实验结果不能作为相应定律或原理的证据之一的是( )
(阿伏加德罗定律:在同温同压下,相同体积的任何气体含有相同数目的分子)
A | B | C | D | |
勒夏特列原理 | 元素周期律 | 盖斯定律 | 阿伏伽德罗定律 | |
实验方案 |
|
|
|
|
结果 | 左球气体颜色加深 右球气体颜色变浅 | 烧瓶中冒气泡 试管中出现浑浊 | 测得 |
|
A. AB. BC. CD. D