题目内容
【题目】一氯甲烷(CH3Cl)一种重要的化工原料,常温下它是无色有毒气体,微溶于水,易溶于乙醇、CCl4等有机浓剂。
(1)甲组同学在实验室用装置A模拟催化法制备一氯甲烷并检验CH3Cl的稳定性。
A.  B.
B.  C.
C. 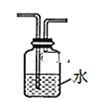 D.
D. 
①装置A中仪器a的名称为__________,a瓶中发生反应的化学方程式为________。
②实验室干燥ZnCl2晶体制备无水ZnCl2的方法是________。
(2)为探究CH3Cl与CH4分子稳定性的差别,乙组同学设计实验验证CH3C1能被酸性KMnO4溶液氧化。
①为达到实验目的,上面装置图中装置连接的合理顺序为A________
②装置中水的主要作用是__________。
③若实验过程中还产生了一种黄绿色气体和一种无色气体,该反应的离子方程式为_____。
(3)丙组同学选用A装置设计实验探究甲醇的转化率。取6.4g甲醇与足量的浓盐酸充分反应,将收集到的CH3Cl气体在足量的氧气中充分燃烧,产物用过量的V1mL、c1mol·L-1NaOH溶液充分吸收。现以甲基橙作指示剂,用c2mol·L-1盐酸标准溶液对吸收液进行返滴定,最终消耗V2mL盐酸。(已知:2CH3Cl+3O2![]() 2CO2+2H2O+2HCl)
2CO2+2H2O+2HCl)
①滴定终点的现象为____________
②该反应甲醇的转化率为________。(用含有V、c的式子表示)
【答案】圆底烧瓶 CH3OH+HCl(浓)→CH3Cl+H2O 在HC1气流中小心加热 C-D-B 除去CH3C1中的HCl和甲醇,防止对后续试验的干扰 10CH3Cl+14MnO4-+42H+=10CO2↑+5Cl2↑+14Mn2++36H2O 溶液颜色由黄色变为橙色,且半分钟内不变化 ![]()
【解析】
(1)①根据仪器a特点,得出仪器a为圆底烧瓶;根据实验目的,装置A是制备CH3Cl,据此分析;
②ZnCl2为强酸弱碱盐,Zn2+能发生水解,制备无水ZnCl2时,需要防止Zn2+水解;
(2)①A是制备CH3Cl的装置,CH3Cl中混有甲醇和HCl,甲醇和HCl能使酸性高锰酸钾溶液褪色,干扰实验,必须除去,利用它们溶于水,需要通过C装置,然后通过D装置验证CH3Cl能被酸性高锰酸钾溶液氧化最后通过B装置;
②根据①分析;
③黄绿色气体为Cl2,利用高锰酸钾溶液的氧化性,将CH3Cl中C氧化成CO2,高锰酸钾中Mn元素被还原成Mn2+,据此分析;
(3)①使用盐酸滴定,甲基橙作指示剂,终点是溶液颜色由黄色变为橙色,且半分钟内不变化;
②CH3Cl燃烧生成CO2和HCl,CO2和HCl被NaOH所吸收,然后用盐酸滴定过量的NaOH溶液和Na2CO3溶液,据此分析;
(1)①根据仪器a的特点,仪器a的名称为圆底烧瓶,根据实验目的,装置A制备CH3Cl,HCl中Cl取代CH3OH中羟基,则a瓶中的反应方程式为CH3OH+HCl(浓)→CH3Cl+H2O;
答案:圆底烧瓶;CH3OH+HCl(浓)→CH3Cl+H2O;
②ZnCl2为强酸弱碱盐,Zn2+发生水解,因此实验室干燥ZnCl2晶体制备无水ZnCl2的方法是在HC1气流中小心加热;
答案:在HC1气流中小心加热;
(2)①根据实验目的,装置A制备CH3Cl,甲醇和浓盐酸易挥发, CH3C1中含有HCl和甲醇等杂质,HCl和甲醇均能使酸性KMnO4溶液褪色,干扰后续实验,利用甲醇和HCl易溶于水,通入KMnO4溶液前需用水除去,然后再通入酸性高锰酸钾溶液,根据③得到黄绿色气体,黄绿色气体为Cl2,氯气有毒,污染环境,因此最后通入CCl4溶液,除去Cl2等有毒气体,则连接顺序是A→C→D→B;
答案:C→D→B;
②根据①分析,水的作用是除去CH3C1中的HCl和甲醇;
答案:除去CH3Cl中的HCl和甲醇,防止对后续实验的干扰;
③黄绿色气体为Cl2,利用高锰酸钾溶液的氧化性,将CH3Cl中C氧化成CO2,高锰酸钾中Mn元素被还原成Mn2+,根据化合价升降法、原子守恒和电荷守恒,得到l0CH3Cl+14MnO4-+42H+=10CO2↑+5Cl2↑+14Mn2++36H2O;
答案:l0CH3Cl+14MnO4-+42H+=10CO2↑+5Cl2↑+14Mn2++36H2O;
(3)①燃烧生成的CO2和HCl全部被NaOH溶液充分吸收,溶液中的溶质有NaOH、NaCl、Na2CO3,用甲基橙作指示剂,盐酸进行滴定,滴定终点的产物为NaCl,滴定终点的现象为溶液颜色由黄色变为橙色,且半分钟内不变化;
答案:溶液颜色由黄色变为橙色,且半分钟(30s)内不变化;
②根据①的分析,最后溶质为NaCl,NaCl中氯元素来自于CH3Cl和盐酸,根据Cl元素守恒可得CH3Cl中的n(Cl)= n(CH3Cl) -n(HCl)=(c1V1-c2V2)×10-3,甲醇的转化率是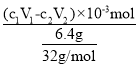 =
=![]() ;
;
答案:![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】(1)12g碳与适量水蒸气反应生成CO和H2,需吸收131.3KJ热量,此反应的热化学方程式为______________________________。
(2)已知以下的热化学反应方程式:
①2CO(g)+O2(g)=2CO2(g) △H=-566kJ/mol
②2H2(g)+O2(g)=2H2O(g) △H=-484kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890kJ/mol
则:CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=______。
(3)已知H2(g)+Br2(l)=2HBr(g) △H=-102kJ/mol,其他的相关数据如下表:
H2(g) | Br2(l) | HBr(g) | |
1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | a | 369 |
则表中a为_______。
【题目】甲醇是重要的化学工业基础原料和液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度(℃) | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+ CO2(g) | K3 | ||
(1)反应②是___________(填“吸热”或“放热”)反应。
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图所示。则平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。

(3)判断反应③△H______0; △S______0(填“>”“=”或“<”)在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、 CH3OH、H2O的物质的量分别为6mol、2 mol、10 mol、10 mol,此时v(正)_____v(逆)(填“>”“=”或“<”)
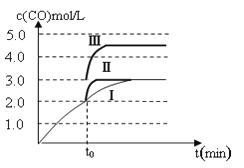
(4)一定温度下,在3 L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是________________。