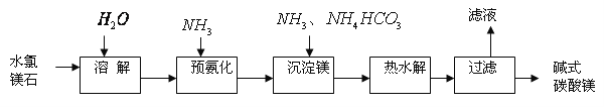
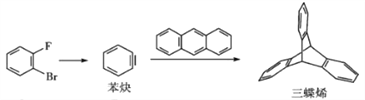
��Ŀ����
����Ŀ��ij����С���ͬѧ����ʵ������п��Ũ���ᷴӦ��ʵ���У���ͬѧ��Ϊ�����������Ƕ���������ͬѧ��Ϊ���������������⣬�����ܲ���������Ϊ����֤��λͬѧ���ж���ȷ����ͬѧ�������ͼ1��ʾʵ��װ�ã�п��Ũ���Ṳ��ʱ����������ΪX�����巢��װ����ȥ�����Իش� 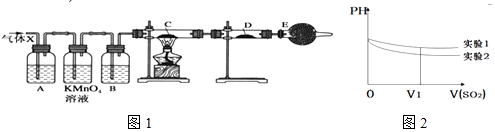
��1��������Ӧ�����ɶ�������Ļ�ѧ����ʽΪ ��
��2����ͬѧ��Ϊ�����ܲ��������������� ��
��3��A�м�����Լ������� �� ��������B�м�����Լ������� �� ��������
��4������֤������X�к���������ʵ�������ǣ�C�У� �� D�У� ��
��5��II����С��ͬѧ���ռ���SO2����ͨ��0.1molL��1��Ba��NO3��2��Һ�У��õ���BaSO4������Ϊ̽��������Һ�к�����������ͨ���SO2 �� ��С����������¼��裺 ����һ����Һ�е�NO3��
���������Һ���ܽ��O2
��С�����ʵ����֤�˼���һ��
�����±��հ״���д���ʵ������
ʵ�鲽�� | ʵ������ | ���� |
ʵ��1����ʢ�в���O2��25ml0.1mol/LBaCl2��Һ���ձ��У�����ͨ�봿����SO2���� | ����һ���� | |
ʵ��2����ʢ�в���O2��25ml0.1mol/LBa��NO3��2��Һ���ձ��У�����ͨ�봿����SO2���� |
��6��Ϊ�����о��÷�Ӧ����С�黹�����������ʵ������Һ��pH��ͨ��SO2����ı仯������ͼ2��ʵ��1����ҺpH��С��ԭ����V1ʱ��ʵ��2����ҺpHС��ʵ��1��ԭ���ǣ������ӷ���ʽ��ʾ�� ��
���𰸡�
��1��Zn+2H2SO4��Ũ�� ![]() ?ZnSO4+SO2��+2H2O
?ZnSO4+SO2��+2H2O
��2����Zn��ŨH2SO4��Ӧ�����У�H2SO4����������ˮ���ɣ�H2SO4Ũ����С�����ϡ���ᣬZn��ϡH2SO4��Ӧ����H2
��3��Ʒ����Һ������SO2��ŨH2SO4������ˮ����
��4����ɫ��CuO����ĩ��ɺ�ɫ��Cu������ɫ��ĩ�����ɫ
��5��������ɫ��������
��6��SO2����ˮ������H2SO3 �� �����������ԣ���pHֵ��С��3SO2+2H2O+2NO3�� ![]() ?2NO+4H++3SO42����
?2NO+4H++3SO42����
���������⣺��1������������п��Ũ���ᷴӦ�õ���п��Ũ���ᷴӦ�ö�����������п��ˮ����Ӧ�Ļ�ѧ����ʽΪ��Zn+2H2SO4��Ũ�� ![]() ZnSO4+SO2��+2H2O�� ���Դ��ǣ�Zn+2H2SO4��Ũ��
ZnSO4+SO2��+2H2O�� ���Դ��ǣ�Zn+2H2SO4��Ũ�� ![]() ZnSO4+SO2��+2H2O����2����Zn��ŨH2SO4��Ӧ�����У�H2SO4����������ˮ���ɣ�H2SO4Ũ����С�����ϡ���ᣬZn��ϡH2SO4��Ӧ����H2��
ZnSO4+SO2��+2H2O����2����Zn��ŨH2SO4��Ӧ�����У�H2SO4����������ˮ���ɣ�H2SO4Ũ����С�����ϡ���ᣬZn��ϡH2SO4��Ӧ����H2��
���Դ��ǣ���Zn��ŨH2SO4��Ӧ�����У�H2SO4����������ˮ���ɣ�H2SO4Ũ����С�����ϡ���ᣬZn��ϡH2SO4��Ӧ����H2�� ��3������װ��ͼ��֪�����ɵ��������ж������������������װ��A����֤����������ڵ�װ�ã�ѡƷ����Һ������֤��ͨ�����������Һ��ȥ��������ͨ��װ��B�е�Ũ�����ȥˮ������
���Դ��ǣ�Ʒ����Һ������SO2��ŨH2SO4������ˮ��������4��֤�����ɵ������к���ˮ����������Cװ���к�ɫ����ͭ��Ϊ��ɫͭ��Dװ���а�ɫ����ͭ��Ϊ��ɫ��
���Դ��ǣ���ɫ������ͭ����ĩ��ɺ�ɫ��ͭ������ɫ��ĩ�����ɫ����5������������Դ��������ᣬ������������Ȼ�������Ӧ����ʵ��1��������
Ba��NO3��2��Һ�л���ͨ�봿����SO2���壬����������ԭ��Ӧ�������ᱵ��������ʵ��2�����ɰ�ɫ����������һ������
���Դ��ǣ�
ʵ�鲽�� | ʵ������ | ���� |
ʵ��1����ʢ�в���O2��25mL0.1molL��1BaCl2��Һ���ձ��У�����ͨ�봿����SO2���� | ������ | ����һ���� |
ʵ��2����ʢ�в���O2��25mL0.1molL��1Ba��NO3��2��Һ���ձ��У�����ͨ�봿����SO2���� | ��ɫ�������� |
;��6��ʵ��1����ҺpH��С��ԭ����SO2����ˮ������H2SO3 �� �����������ԣ���pHֵ��С��ʵ��2����ҺpHС��ʵ��1��ԭ����3SO2+2H2O+2NO3��=2NO+4H++3SO42�� ��
���Դ��ǣ�SO2����ˮ������H2SO3 �� �����������ԣ���pHֵ��С��3SO2+2H2O+2NO3�� ![]() 2NO+4H++3SO42�� ��
2NO+4H++3SO42�� ��

 ��У����ϵ�д�
��У����ϵ�д�