��Ŀ����
����Ŀ��ijѧϰ��ȤС�������ø�����������Ҫ�ɷ���Al2O32SiO22H2O���Ʊ����͵ľ�ˮ����ʵ��������ͼ�� 
������ҺC�������Ʊ��ľ�ˮ����������������⣺
��1�������A��B����ҺC������D����Ҫ�ɷ֣�A��B��CD ��
��2��д���������봿��������ڵ�������ѧ����ʽ����
��3����ʵ���У����ڸ�����������Ļ�������ѡ�õ������� ��
A.��������
B.������
C.����������
D.��������
���𰸡�
��1��NaAlO2��Na2SiO3��AlCl3��H2SiO3��AlCl3��H2SiO3
��2��Na2CO3+Al2O3 ![]() ?2NaAlO2+CO2����Na2CO3+SiO2
?2NaAlO2+CO2����Na2CO3+SiO2 ![]() ?Na2SiO3+CO2��
?Na2SiO3+CO2��
��3��D
���������⣺��1���������Ͷ��������ڸ�������״̬���봿�Ӧ����A�ɷ�Ϊ�����ƺ�ƫ�����ƣ�A�м�ˮ�ܽⲢ���˺�õ�����Ҫ�ǹ�������ƫ�����ƵĻ��Һ��AΪNaAlO2��Na2SiO3 �� �μӹ�����������ɹ���������Ȼ�����Һ��BΪAlCl3��H2SiO3�Ļ������˺�IJ��������DΪH2SiO3 �� ��ҺCΪAlCl3��Һ�� ���Դ��ǣ�NaAlO2��Na2SiO3��AlCl3��H2SiO3��AlCl3��H2SiO3����2���������Լ�����������̼���Ƶķ�ӦΪ��Na2CO3+Al2O3 ![]() 2NaAlO2+CO2����Na2CO3+SiO2
2NaAlO2+CO2����Na2CO3+SiO2 ![]() Na2SiO3+CO2����
Na2SiO3+CO2����
���Դ��ǣ�Na2CO3+Al2O3 ![]() 2NaAlO2+CO2����Na2CO3+SiO2
2NaAlO2+CO2����Na2CO3+SiO2 ![]() Na2SiO3+CO2������3�������������������ijɷ��к��ж������裬�ܺʹ������Ӧ������������Ҳ�ܺʹ������Ӧ���ڼ���ʱ��Ӧ��ʹ����ը�ѣ���Ӧѡ����������
Na2SiO3+CO2������3�������������������ijɷ��к��ж������裬�ܺʹ������Ӧ������������Ҳ�ܺʹ������Ӧ���ڼ���ʱ��Ӧ��ʹ����ը�ѣ���Ӧѡ����������
���Դ��ǣ�D��

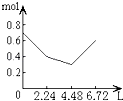
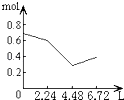
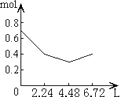
����Ŀ��PCl3��PCl5������Ҫ�Ļ���ԭ�ϡ���PCl3(g)��Cl2(g)������������2 L�ܱ������У���һ�������·���������Ӧ��10 minʱ�ﵽƽ�⣺PCl3(g) + Cl2(g)![]() PCl5(g)�й��������£������жϲ���ȷ����
PCl5(g)�й��������£������жϲ���ȷ����
PCl3(g) | Cl2(g) | PCl5(g) | |
��ʼŨ��(mol/L) | 2.0 | 1.0 | 0 |
ƽ��Ũ��(mol/L) | c1 | c2 | 0.4 |
A. 10 min�ڣ�v(Cl2) = 0.04 mol/(L��min)
B. ��������Cl2Ϊ1.2 molʱ����Ӧ�ﵽƽ��
C. �������¶�(T1��T2)ʱ���÷�Ӧƽ�ⳣ����С����ƽ��ʱPCl3��![]()
D. ƽ�������2.0 mol PCl3��1.0 molCl2������ͬ�������ٴ�ƽ��ʱ��c(PCl5)��0.2 mol/L
����Ŀ��ij����С���ͬѧ����ʵ������п��Ũ���ᷴӦ��ʵ���У���ͬѧ��Ϊ�����������Ƕ���������ͬѧ��Ϊ���������������⣬�����ܲ���������Ϊ����֤��λͬѧ���ж���ȷ����ͬѧ�������ͼ1��ʾʵ��װ�ã�п��Ũ���Ṳ��ʱ����������ΪX�����巢��װ����ȥ�����Իش� 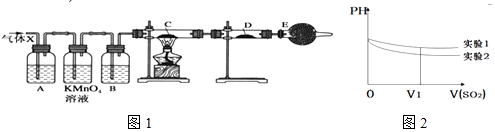
��1��������Ӧ�����ɶ�������Ļ�ѧ����ʽΪ ��
��2����ͬѧ��Ϊ�����ܲ��������������� ��
��3��A�м�����Լ������� �� ��������B�м�����Լ������� �� ��������
��4������֤������X�к���������ʵ�������ǣ�C�У� �� D�У� ��
��5��II����С��ͬѧ���ռ���SO2����ͨ��0.1molL��1��Ba��NO3��2��Һ�У��õ���BaSO4������Ϊ̽��������Һ�к�����������ͨ���SO2 �� ��С����������¼��裺 ����һ����Һ�е�NO3��
���������Һ���ܽ��O2
��С�����ʵ����֤�˼���һ��
�����±��հ״���д���ʵ������
ʵ�鲽�� | ʵ������ | ���� |
ʵ��1����ʢ�в���O2��25ml0.1mol/LBaCl2��Һ���ձ��У�����ͨ�봿����SO2���� | ����һ���� | |
ʵ��2����ʢ�в���O2��25ml0.1mol/LBa��NO3��2��Һ���ձ��У�����ͨ�봿����SO2���� |
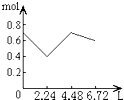
��6��Ϊ�����о��÷�Ӧ����С�黹�����������ʵ������Һ��pH��ͨ��SO2����ı仯������ͼ2��ʵ��1����ҺpH��С��ԭ����V1ʱ��ʵ��2����ҺpHС��ʵ��1��ԭ���ǣ������ӷ���ʽ��ʾ�� ��
����Ŀ��ʵ�������ĸ�ҩƷ�����Ѵ������ҩƷ��
�� | �׳� | �ҳ� | ���� | ���� |
ҩƷ | ���ᡢ���� | CCl4��C2H5OH | ���ס��� | ͭ��п |
ʵ�����¹���һЩ����̿��Ӧ���������
A. �׳� B. �ҳ� C. ���� D. ����