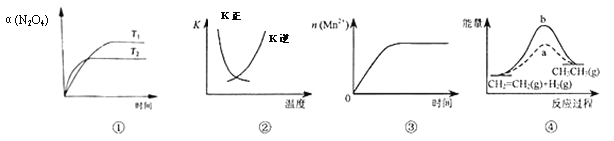
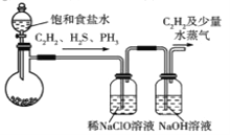
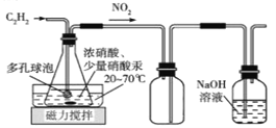
��Ŀ����
����Ŀ�������������������´ɡ��մɡ������������ϵ���ɫ�����ɸ�̼�����Ͻ𣨺�Cr��Fe��C���Ʊ������������Ĺ����������£�

��֪��Cr(OH)3���������������������Ϊ���
�ش��������⣺
��1����������ȡʱ��Ϊ��߽�ȡ���ʣ�������̼�����Ͻ��Ƴɷ�ĩ�⣬���ɲ�ȡ�Ĵ�ʩ��__________________________��дһ�㣩����ȡ��ʱ��Ӧ�����ӷ���ʽΪ_______________��
��2�����������������ٴν�ȡ��Ŀ����_____________________________________________��
��3������������ʱ����Һ��pH������ȥ����Ӱ����ͼ1��ʾ��

ͼ1 ͼ2
pHС��2.3ʱ����ȥ���ʵͣ���ԭ����_______________________________________��
��4����������˵��������ϴ�Ӹɾ��IJ�����________________________________________��
��5������������ʱ������Cr(OH)3�Ļ�ѧ����ʽΪ_____________________________������ʱ����ҺpH����Ļ����ʹ�ϵ��ͼ2��ʾ����pH��8.5ʱ��pHԽ���Ļ�����Խ�ͣ������ԭ����____________________________________________��
���𰸡� �ʵ���������Ũ�Ȼ��ʵ���߽�ȡҺ�¶Ȼ���� 2Cr+6H+ ===2Cr3++3H2�� ��߸��Ľ�ȡ�� H2C2O4�������C2O42- Ũ�ȵͣ�������FeC2O4��2H2O���� �����һ��ϴ��Һ�е���BaCl2��Һ���ް�ɫ���� Cr2(SO4)3+6NH4HCO3 ===2Cr(OH)3��+3(NH4)2SO4+6CO2�� Cr(OH)3 ������ǿ���Ե���Һ��
����������1������Ӱ�컯ѧ��Ӧ���ʵ��������ڹ�Һ��Ӧ������ѹǿ�����Կɿ���Ũ�ȡ��¶ȼ��Ӵ�����ȣ����ʵ���������Ũ�Ȼ��ʵ���߽�ȡҺ�¶Ȼ���������������������Ϣ�ɵã�����ȡ���������۸��Ļ�����ʸ�Ӧ���ǽϻ��ý�������ϡ���ᷴӦ��������������������ӷ���ʽΪ��2Cr+6H+ =2Cr3++3H2����
��2����������������ٴν�ȡ����ʹ���е���Ч�ɷ�CrԪ�ر���ֽ�ȡ����߸��Ľ�ȡ����
��3����������ʱ��������ӦΪ��Fe2+ +C2O42- +2H2O![]() FeC2O4��2H2O�����������ᣬH2C2O4
FeC2O4��2H2O�����������ᣬH2C2O4![]() H++HC2O4-��HC2O4-
H++HC2O4-��HC2O4-![]() H++ C2O42-��pHԽС����Һ��H+Ũ��Խ����������룬C2O42- Ũ��С�������ڳ�����Ӧƽ�����ơ�
H++ C2O42-��pHԽС����Һ��H+Ũ��Խ����������룬C2O42- Ũ��С�������ڳ�����Ӧƽ�����ơ�
��4����ȡ��ʹ�õ���ϡ���ᣬ��Ҫ���鲽����ij����Ƿ���ϴ�Ӹɾ������Լ���SO42-�������һ��ϴ��Һ�е���BaCl2��Һ�����ް�ɫ��������˵��������ϴ�Ӹɾ���
��5���������̿ɵã�����֮ǰΪCr2(SO4)3��Һ������NH4HCO3������������Cr(OH)3�⣬��������狀�CO2���ɣ���ѧ����ʽΪ��Cr2(SO4)3+6NH4HCO3=2Cr(OH)3��+3(NH4)2SO4+6CO2��������֪Cr(OH)3������������������ͼ2��ʾ����pH��8.5ʱ��pHԽ���Ļ�����Խ�ͣ�����ΪCr(OH)3������ǿ���Ե���Һ����

����Ŀ��ij����С���ͬѧ����ʵ������п��Ũ���ᷴӦ��ʵ���У���ͬѧ��Ϊ�����������Ƕ���������ͬѧ��Ϊ���������������⣬�����ܲ���������Ϊ����֤��λͬѧ���ж���ȷ����ͬѧ�������ͼ1��ʾʵ��װ�ã�п��Ũ���Ṳ��ʱ����������ΪX�����巢��װ����ȥ�����Իش� 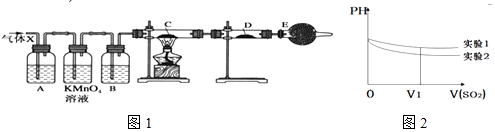
��1��������Ӧ�����ɶ�������Ļ�ѧ����ʽΪ ��
��2����ͬѧ��Ϊ�����ܲ��������������� ��
��3��A�м�����Լ������� �� ��������B�м�����Լ������� �� ��������
��4������֤������X�к���������ʵ�������ǣ�C�У� �� D�У� ��
��5��II����С��ͬѧ���ռ���SO2����ͨ��0.1molL��1��Ba��NO3��2��Һ�У��õ���BaSO4������Ϊ̽��������Һ�к�����������ͨ���SO2 �� ��С����������¼��裺 ����һ����Һ�е�NO3��
���������Һ���ܽ��O2
��С�����ʵ����֤�˼���һ��
�����±��հ״���д���ʵ������
ʵ�鲽�� | ʵ������ | ���� |
ʵ��1����ʢ�в���O2��25ml0.1mol/LBaCl2��Һ���ձ��У�����ͨ�봿����SO2���� | ����һ���� | |
ʵ��2����ʢ�в���O2��25ml0.1mol/LBa��NO3��2��Һ���ձ��У�����ͨ�봿����SO2���� |
��6��Ϊ�����о��÷�Ӧ����С�黹�����������ʵ������Һ��pH��ͨ��SO2����ı仯������ͼ2��ʵ��1����ҺpH��С��ԭ����V1ʱ��ʵ��2����ҺpHС��ʵ��1��ԭ���ǣ������ӷ���ʽ��ʾ�� ��
����Ŀ��ʵ�������ĸ�ҩƷ�����Ѵ������ҩƷ��
�� | �׳� | �ҳ� | ���� | ���� |
ҩƷ | ���ᡢ���� | CCl4��C2H5OH | ���ס��� | ͭ��п |
ʵ�����¹���һЩ����̿��Ӧ���������
A. �׳� B. �ҳ� C. ���� D. ����