题目内容
【题目】以水氯镁石(主要成分为MgCl2·6H2O)为原料生产碱式碳酸镁的主要流程如下:
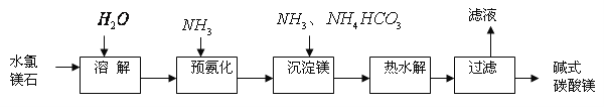
(1)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式为___________________,检验其中阳离子的实验方法是__________________________________________________。
(2)上述过程中的过滤操作所用的主要玻璃仪器有________________________________。
(3)高温煅烧碱式碳酸镁得到MgO。取碱式碳酸镁4.66g,高温煅烧至恒重,得到固体2.00g和标准状况下CO2 0.896L,通过计算确定碱式碳酸镁的化学式_____(写出计算过程,否则不得分)。
【答案】 NH4Cl 取少量该固体于试管中配成溶液,向试管中加入适量的氢氧化钠溶液,然后加热试管,将湿润的红色石蕊试纸(或PH试纸)放在试管口,试纸变蓝,则可说明其中有铵根离子存在。 玻璃棒、漏斗、烧杯 n(CO2)=0.896L/22.4L·mol-1=4.00×10-2 mol
n(MgO)=2.00g/40g·mol-1=5.00×10-2 mol
n(H2O)=(4.66g-4.00×10-2 mol×44g·mol-1-2.00g)/18g·mol-1=5.00×10-2 mol
n(MgO):n(CO2): n(H2O)=5.00×10-2: 4.00×10-2:5.00×10-2=5:4:5
碱式碳酸镁的化学式为:Mg(OH)2·4 MgCO3·4H2O(或Mg5(OH)2(CO3)4·4H2O)
【解析】(1)在氯化镁中加入氨水和碳酸氢铵后,生成碱式碳酸镁,根据质量守恒可知溶液中存在氯化铵,可用于氮肥等;固体中阳离子是铵根离子,检验铵根离子的操作为:取少量该固体于试管中配成溶液,向试管中加入适量的氢氧化钠溶液,然后加热试管,将湿润的红色石蕊试纸(或PH试纸)放在试管口,试纸变蓝,则可说明其中有铵根离子存在。
(2)过滤操作所用的主要玻璃仪器有玻璃棒、漏斗、烧杯;
(3)n(CO2)=0.896L/22.4L·mol-1=4.00×10-2 mol;
高温煅烧碱式碳酸镁至恒重(类似碱式碳酸铜的受热分解),得到的固体为氧化镁,1则n(MgO)=2.00g/40g·mol-1=5.00×10-2 mol;n(H2O)=(4.66g-4.00×10-2 mol×44g·mol-1-2.00g)/18g·mol-1=5.00×10-2 mol;
n(MgO):n(CO2): n(H2O)=5.00×10-2:4.00×10-2:5.00×10-2=5:4:5 ,因氢氧化镁分解时每生成1mol氧化镁和1mol水, 故碱式碳酸镁的化学式为:5Mg(OH)2·4 MgCO3·4H2O。

 全程金卷系列答案
全程金卷系列答案 快乐5加2金卷系列答案
快乐5加2金卷系列答案【题目】在![]() 密闭容器内,800℃时反应:
密闭容器内,800℃时反应: ![]() 体系中,
体系中, ![]() 随时间的变化如表:
随时间的变化如表:
时间 |
|
|
|
|
|
|
|
|
|
|
|
(1)写出该反应的平衡常数表达式: ![]() ___.已知:
___.已知: ![]() ,则该反应是____热反应.
,则该反应是____热反应.
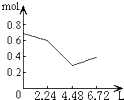
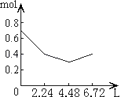
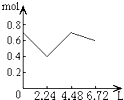
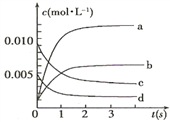
(2)如图中表示![]() 的变化的曲线是_____;用
的变化的曲线是_____;用![]() 表示从
表示从![]() 内该反应的平均速率
内该反应的平均速率![]() ____.
____.
(3)能说明该反应已达到平衡状态的是________.
![]()
![]() .容器内压强保持不变
.容器内压强保持不变
![]() .
. ![]()
![]() .容器内密度保持不变
.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是________.
![]() .及时分离除
.及时分离除![]() 气体
气体![]() .适当升高温度
.适当升高温度
![]() .增大
.增大![]() 的浓度
的浓度![]() .选择高效催化剂
.选择高效催化剂
【题目】某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验中,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气.为了验证哪位同学的判断正确,丙同学设计了如图1所示实验装置(锌与浓硫酸共热时产生的气体为X,气体发生装置略去).试回答: 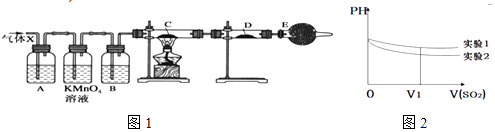
(1)上述反应中生成二氧化硫的化学方程式为 .
(2)乙同学认为还可能产生氢气的理由是 .
(3)A中加入的试剂可能是 , 作用是;B中加入的试剂可能是 , 作用是;
(4)可以证明气体X中含有氢气的实验现象是:C中: , D中: .
(5)II.该小组同学将收集的SO2气体通入0.1molL﹣1的Ba(NO3)2溶液中,得到了BaSO4沉淀,为探究上述溶液中何种微粒能氧化通入的SO2 , 该小组提出了如下假设: 假设一:溶液中的NO3﹣
假设二:溶液中溶解的O2
该小组设计实验验证了假设一,
请在下表空白处填写相关实验现象
实验步骤 | 实验现象 | 结论 |
实验1:在盛有不含O2的25ml0.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | 假设一成立 | |
实验2:在盛有不含O2的25ml0.1mol/LBa(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体 |
(6)为深入研究该反应,该小组还测得上述两个实验中溶液的pH随通入SO2体积的变化曲线如图2,实验1中溶液pH变小的原因是V1时,实验2中溶液pH小于实验1的原因是(用离子方程式表示) .