题目内容
5.同周期的X、Y、Z三元素,其最高价氧化物水化物的酸性由弱到强的顺序是:H3ZO4<H2YO4<HXO4,则下列判断正确的是( )| A. | 原子半径 X>Y>Z | |
| B. | 非金属性 X>Y>Z | |
| C. | 阴离子的还原性按X、Y、Z的顺序由强到弱 | |
| D. | 气态氢化物的稳定性按X、Y、Z的顺序由弱到强 |
分析 同周期自左向右原子半径逐渐减小,非金属性逐渐增强,最高价氧化物的水化物的酸性逐渐增强,相应氢化物的稳定性逐渐增强,由于最高价氧化物水化物的酸性由弱到强的顺序是:H3ZO4<H2YO4<HXO4,所以非金属性是X>Y>Z,非金属性越强,相应阴离子的还原性越弱.
解答 解:同周期的X、Y、Z三元素,其最高价氧化物水化物的酸性由弱到强的顺序是:H3ZO4<H2YO4<HXO4,所以非金属性是X>Y>Z.
A.同周期自左向右原子半径逐渐减小,非金属性逐渐增强,故原子半径:X<Y<Z,故A错误;
B.由上述分析可知,非金属性是X>Y>Z,故B正确;
C.非金属性越强,氢化物越稳定,故相应氢化物的稳定性:X>Y>Z,故C错误;
D.非金属性越强,相应阴离子的还原性越弱,故阴离子的还原性按X、Y、Z的顺序由弱到强,故D错误,
故选:B.
点评 本题考查元素周期律,难度不大,注意理解同周期元素性质递变规律,知道非金属性强弱判断方法,注意:非金属性强弱与得电子难易程度有关.

练习册系列答案
相关题目
13.2011年3月11日,日本发生地震,引起核泄漏,放射性物质${\;}_{53}^{131}I$进入大气.${\;}_{53}^{131}I$原子核内中子数是( )
| A. | 53 | B. | 78 | C. | 131 | D. | 184 |
20.下列化学表达方式不正确的是( )
| A. | 中子数为20的氯原子:37Cl | B. | Cl-的结构示意图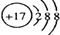 | ||
| C. | 氢氧根离子的电子式: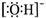 | D. | HClO的结构式 H-Cl-O |
10.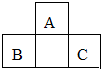 短周期元素A、B、C的位置如图所示,已知B、C两元素的原子序数之和是A元素的4倍,则A、B、C依次是( )
短周期元素A、B、C的位置如图所示,已知B、C两元素的原子序数之和是A元素的4倍,则A、B、C依次是( )
 短周期元素A、B、C的位置如图所示,已知B、C两元素的原子序数之和是A元素的4倍,则A、B、C依次是( )
短周期元素A、B、C的位置如图所示,已知B、C两元素的原子序数之和是A元素的4倍,则A、B、C依次是( )| A. | Be、Na、Al | B. | C、Al、P | C. | B、Mg、Si | D. | O、P、Cl |
17.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 2L0.5mol/L亚硫酸溶液中含有的H+数为2NA | |
| C. | 42g乙烯和丙烯的混合气体充分燃烧消耗氧气的分子数为4.5 NA | |
| D. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |
