题目内容
19.在HS-中S的杂化类型是sp3.分析 根据在HS-中S的中心原子含有的共价键个数与孤电子对个数之和确定其空间构型和杂化方式.
解答 解:HS-中S的中心原子中含有3个孤电子对和1个σ键,杂化轨道数3+1=4,故硫原子采取sp3杂化;
故答案为:sp3.
点评 本题考查离子空间构型及杂化方式的判断,根据价层电子对互斥理论来分析解答即可,难度不大.

练习册系列答案
相关题目
2.下列有关碳族元素的说法正确的是( )
①原子最外层电子数是4
②碳与强氧化剂氯气反应时失去4个电子生成离子化合物四氯化碳
③石墨在一定条件下转化为金刚石是化学变化
④铅的熔点比锗高,锡的熔点比铅低
⑤单质都是无色晶体
⑥从CPb,其最高价氧化物对应水化物的酸性逐渐增强
⑦除Pb外,其他元素的+4价化合物是稳定的
⑧稳定性SiF4<CH4<H2O<HF
⑨硅的非金属性比金属性强,而锗的金属性比非金属性强.
①原子最外层电子数是4
②碳与强氧化剂氯气反应时失去4个电子生成离子化合物四氯化碳
③石墨在一定条件下转化为金刚石是化学变化
④铅的熔点比锗高,锡的熔点比铅低
⑤单质都是无色晶体
⑥从CPb,其最高价氧化物对应水化物的酸性逐渐增强
⑦除Pb外,其他元素的+4价化合物是稳定的
⑧稳定性SiF4<CH4<H2O<HF
⑨硅的非金属性比金属性强,而锗的金属性比非金属性强.
| A. | ①②③⑤⑧⑨ | B. | ①③⑦⑧⑨ | C. | ②④⑤⑥ | D. | 全部 |
10.已知NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 46g甘油中存在的共价键总数为6.5NA | |
| B. | 标准状况下,50mL12mol/L盐酸与足量MnO2共热,可产生3.36LCl2 | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA | |
| D. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |
7.能正确表示下列化学反应的离子方程式的是( )
| A. | 金属铝溶于盐酸中:Al+2H+=Al3++H2↑ | |
| B. | 碳酸钙溶于硝酸中:2H++CO${\;}_{3}^{2-}$=CO2↑+H2O | |
| C. | 硫酸氢钠溶液中加入碳酸氢钠溶液:H++HCO${\;}_{3}^{-}$=CO2↑+H2O | |
| D. | 在澄清石灰水中通入过量的CO2:Ca2++2OH-+CO2=CaCO3↓+H2O |
1.氢核聚变能产生大量的能量,而高纯度铍(Be)是制造核聚变反应装置中最核心的部件之一的屏蔽包的主要材料.据中新网2009年2月6日报道,我国科学家己成功地掌握了获取高纯度铍的技术.下列有关说法错误的是( )
| A. | 10Be、9Be、8Be核内质子数均是4 | |
| B. | Be元素在元素周期表的p区 | |
| C. | 氢核聚变后会产生新元素 | |
| D. | 从矿物中提取单质铍的过程中铍一定被还原 |
8.下列文字表述与反应方程式对应且正确的是( )
| A. | 实验室制乙炔:CaC2+H2O→Ca(OH)2+C2H2↑ | |
| B. | 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+═AgBr↓ | |
| C. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+CO32- | |
| D. | 实验室用液溴和苯在催化剂作用下制溴苯: |
5.同周期的X、Y、Z三元素,其最高价氧化物水化物的酸性由弱到强的顺序是:H3ZO4<H2YO4<HXO4,则下列判断正确的是( )
| A. | 原子半径 X>Y>Z | |
| B. | 非金属性 X>Y>Z | |
| C. | 阴离子的还原性按X、Y、Z的顺序由强到弱 | |
| D. | 气态氢化物的稳定性按X、Y、Z的顺序由弱到强 |
 +Br2→
+Br2→ ,反应类型为加成反应.
,反应类型为加成反应.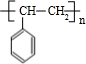 .
.