题目内容
9.设NA为阿伏伽德罗常数的值.下列说法正确的是( )| A. | 1L0.1mol•L-1的醋酸溶液中含有0.1NA个H+ | |
| B. | 1L1mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| C. | 25℃时,1LpH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| D. | 1mol单质硅含有2NA个Si-Si键 |
分析 A.醋酸为弱酸,在溶液中部分电离;
B.次氯酸根离子在溶液中部分水解,导致溶液中次氯酸根离子数目减少;
C.pH=13的溶液中氢氧根离子浓度为0.1mol/L,1L该溶液中含有0.1mol氢氧根离子;
D.1mol硅原子为其它4mol硅原子相连,利用均摊法计算出含有Si-Si键的数目.
解答 解:A.醋酸部分电离,则溶液中的氢离子小于0.1mol,含有的氢离子数小于0.1NA,故A错误;
B.1L1mol•L-1的NaClO溶液中含有溶质次氯酸钠1mol,由于次氯酸根离子部分水解,则溶液中含有的次氯酸根离子小于1mol,含有ClO-的数目小于NA,故B错误;
C.25℃时,1LpH=13的Ba(OH)2溶液中,氢氧根离子浓度为0.1mol/L,1L该溶液中含有0.1mol氢氧根离子,则含有OH-的数目为0.1NA,故C错误;
D.每个Si原子与其它4个Si原子形成了4个Si-Si键,每个Si-Si键为两个Si原子共用,则1mol单质硅形成的Si-Si键的物质的量为:1mol×$4×\frac{1}{2}$=2mol,含有2NA个Si-Si键,故D正确;
故选D.
点评 本题考查阿伏加德罗常数的应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,C、D为易错点,C中注意正确计算氢氧根离子浓度、D中需要利用均摊法计算.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.以下实验能获得成功的是( )
| A. | 要检验溴乙烷中的溴元素,可以加入NaOH溶液共热,冷却后滴入AgNO3溶液,观察有无浅黄色沉淀生成 | |
| B. | 要检验蔗糖的水解产物,将蔗糖的水解液加入到新制的氢氧化铜悬浊液中,加热至沸腾观察是否有红色沉淀产生 | |
| C. | 在进行溴乙烷与NaOH乙醇溶液反应的实验中,将反应产生的气体直接通入到酸性高锰酸钾溶液中来检验产生的气体是否为乙烯 | |
| D. | 将铜丝在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,铜丝恢复成原来的红色,取出,铜丝又会变为黑色,反复几次,用氢氧化铜悬浊液可以证明是否生成了乙醛 |
17.下列各实验装置图的叙述中,正确的是( )


| A. | 装置①可用于分离苯和溴苯的混合物 | |
| B. | 装置②可用于吸收氨气,且能够防止倒吸 | |
| C. | 以NH4Cl为原料,装置③可用于制备NH3 | |
| D. | 剩用装置④可收集Cl2、H2等气体,盛满水时还能收集NO等气体 |
14.下列图示与对应的叙述一定正确的是( )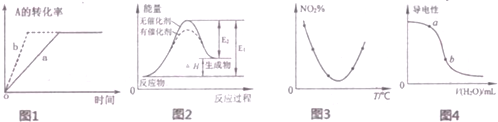

| A. | 图1所示反应:A(g)+2B(g)?3C(g),b曲线表示的一定是增大压强 | |
| B. | 图2表示催化剂能改变化学反应的焓变 | |
| C. | 图3表示等量N02在容积相同的恒容密闭容器中,不同温度下分别发生反应;2NO2(g)?N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 | |
| D. | 图4表示向稀CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b |
19.下列离子方程式正确的是( )
| A. | 用CuSO4溶液将ZnS转化成CuS沉淀:S2-+Cu2+═CuS↓ | |
| B. | NH4HCO3溶液与过量NaOH溶液混合加热:NH${\;}_{4}^{+}$+OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 向酸化的FeSO4溶液中滴入少量H2O2溶液:H2O2+2Fe2++2H+═2Fe3++2H2O | |
| D. | 用惰性电极电解饱和的KCl溶液:2H++2Cl$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2 |

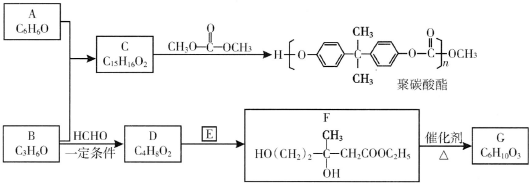
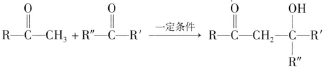 (R、R′、R″为氢原子或烃基)
(R、R′、R″为氢原子或烃基) ,E的分子式是C4H8O2,F生成G的反应类型是取代反应?
,E的分子式是C4H8O2,F生成G的反应类型是取代反应? .G的同分异构体有多种,其中和G具有完全相同环状结构的同分异构体有23种(不包含G,不考虑立体异构).
.G的同分异构体有多种,其中和G具有完全相同环状结构的同分异构体有23种(不包含G,不考虑立体异构).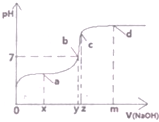 (1)25℃时,向20mL0.1mol•L的醋酸溶液中不断滴入0.1mol•L-1的NaOH溶液,溶液的pH变化曲线如图所示.
(1)25℃时,向20mL0.1mol•L的醋酸溶液中不断滴入0.1mol•L-1的NaOH溶液,溶液的pH变化曲线如图所示.