题目内容
15.肼(N2H4)--空气燃料电池是环保型燃料电池,电解质溶液是20%--30%的KOH其电池总反应式为:N2H4+O2═N2+2H2O负极反应为N2H4+4OH--4e-═4H2O+N2↑.分析 燃料电池中,负极上投放的是燃料,负极上燃料失电子发生氧化反应,电池总反应式即为燃烧方程式;
解答 解:肼(N2H4)--空气燃料电池是环保型燃料电池,电解质溶液是20%--30%的KOH其电池总反应式即为燃烧方程式,所以总反应式为:N2H4+O2═N2+2H2O,负极反应为:N2H4+4OH--4e-═4H2O+N2↑,故答案为:N2H4+O2═N2+2H2O;N2H4+4OH--4e-═4H2O+N2↑.
点评 本题考查了燃料电池的原理,明确燃料电池负极上投放的是燃料,负极上燃料失电子发生氧化反应,正极为氧气发生得电子的还原反应,难度中等.

练习册系列答案
 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案
相关题目
5.下列离子能大量共存,通入足量SO2后,所含离子仍能大量共存的是( )
| A. | NH4+、Al3+、SO42-、AlO2- | B. | Na+、SO32-、Cl-、K+ | ||
| C. | Na+、NH4+、SO42-、Cl- | D. | K+、I-、Cl-、NO3- |
6.实验室用铜和浓硫酸反应制取二氧化硫,下列有关该反应的说法错误的是( )
| A. | 铜是还原剂,发生了氧化反应 | |
| B. | 每生成1 mol SO2,转移电子的物质的量是2 mol | |
| C. | 每消耗 1 mol Cu,起氧化剂作用的硫酸消耗2 mol | |
| D. | 反应后物质中可能有白色固体出现 |
3.下列各组离子在溶液中按括号内的物质的量之比混合,得到无色、碱性、澄清溶液的是( )
| A. | Fe3+、Na+、Cl-、S2- (1:2:3:1) | B. | K+、Cu2+、OH-、SO42- (1:1:1:1) | ||
| C. | NH4+、H+、I -、HCO3- (1:1:1:1) | D. | Na+、Al 3+、Cl -、OH-(4:1:3:4) |
10.能用来分离Fe3+和Al3+离子的试剂是( )
| A. | KSCN | B. | NH3•H2O | C. | NaOH溶液 | D. | H2S溶液 |
4.下面有关晶体的叙述中,错误的是( )
| A. | 金刚石的网状结构中,由共价键形成的最小碳环上有6个碳原子 | |
| B. | 在NaCl晶体中每个Na+(或Cl-)周围都紧邻6个Cl-(或6个Na+) | |
| C. | 白磷晶体中,粒子之间通过共价键结合,键角为60° | |
| D. | 离子晶体在熔化时,离子键被破坏;而分子晶体熔化时,化学键不被破坏 |
5.沪昆高铁在新化洋溪建了一个新化南站,方便了新化及周边县市人们的出行.工业上利用铝热反应焊接钢轨间的缝隙,反应方程式如下:2Al+Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+Al2O3,下列说法正确的是( )
| A. | Al元素被还原 | |
| B. | Al2O3是氧化产物 | |
| C. | Fe2O3既是氧化剂又是还原剂 | |
| D. | 每生成1molFe时,转移电子的物质的量为3mol |

 或
或 等
等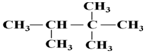 :2,2,3-三甲基丁烷;
:2,2,3-三甲基丁烷;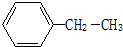 乙苯
乙苯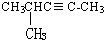 4-甲基-2-戊炔.
4-甲基-2-戊炔.