题目内容
6.实验室用铜和浓硫酸反应制取二氧化硫,下列有关该反应的说法错误的是( )| A. | 铜是还原剂,发生了氧化反应 | |
| B. | 每生成1 mol SO2,转移电子的物质的量是2 mol | |
| C. | 每消耗 1 mol Cu,起氧化剂作用的硫酸消耗2 mol | |
| D. | 反应后物质中可能有白色固体出现 |
分析 根据Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+H2O,利用化合价的变化分析氧化剂、还原剂、消耗的酸及转移的电子数,以此来解答.
解答 解:A.反应中Cu元素的化合价由0升高到+2价,作还原剂,发生氧化反应,故A正确;
B.由Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+H2O可知,每生成1molSO2,转移电子的物质的量为1mol×(6-4)=2mol,故B正确;
C.由Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+H2O可知,每消耗1molCu,起氧化剂作用的硫酸消耗1mol,故C错误;
D.该反应有硫酸铜生成,浓硫酸会把水吸走,硫酸铜固体为白色,故D正确;
故选C.
点评 本题考查铜与浓硫酸的反应,熟悉发生的化学反应及利用化合价分析氧化还原反应即可解答,题目难度不大.

练习册系列答案
 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
2.下列分子的中心原子采取sp杂化的是( )
| A. | XeO4 | B. | BeCl2 | C. | CH4 | D. | PCl3 |
17.下表列出了前20号元素中的某些元素性质的一些数据:
试回答下列问题:
(1)以上10种元素中第一电离能最小的是K(填元素符号).
(2)写出下列有关反应的化学方程式:E的单质与I元素的最高价氧化物对应的水化物反应:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
(3)比元素B原子序数大11的元素的基态原子电子排布式是[Ar]3d104s2.
(4)C和I相比较,非金属性较弱的是N(填元素符号),可以验证你的结论的是下列中的ab(填编号).
a.气态氢化物的稳定性
b.两元素的电负性
c.含氧酸的酸性
d.最高化合价.
| 元素编号 | A | B | C | D | E | F | G | H | I | J |
| 原子半径(10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高正价 | +6 | +1 | 无 | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低负价 | -2 | 无 | -2 | 无 | -4 | -3 | -1 | 无 | -3 | -4 |
(1)以上10种元素中第一电离能最小的是K(填元素符号).
(2)写出下列有关反应的化学方程式:E的单质与I元素的最高价氧化物对应的水化物反应:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
(3)比元素B原子序数大11的元素的基态原子电子排布式是[Ar]3d104s2.
(4)C和I相比较,非金属性较弱的是N(填元素符号),可以验证你的结论的是下列中的ab(填编号).
a.气态氢化物的稳定性
b.两元素的电负性
c.含氧酸的酸性
d.最高化合价.
14.下列表示物质结构的化学用语或模型正确的是( )
| A. | HF的电子式: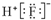 | |
| B. | 二氧化碳的结构式:O=C=O | |
| C. | Cl-离子的结构示意图: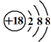 | |
| D. | 质子数为6,中子数为8的微粒:${\;}_{6}^{8}$C |
1.下列物质中:互为同分异构体的是( )
| A. | 液氯、氯气 | B. | CH2=CH-CH3 CH3-CH2-CH3 | ||
| C. | N2、CO | D. | 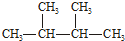 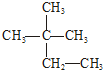 |
11.下列说法不正确的是( )
| A. | (CH3)2C(Cl)CH2CH3的名称为:2-氯-2-甲基丁烷 | |
| B. | 某烷烃主链4个碳原子数的同分异构体有2种,则与其碳原子个数相同的且主链4个碳原子的单烯烃有4种 | |
| C. | 1mol有机物(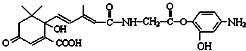 )与NaOH溶液反应,最多消耗5mol NaOH )与NaOH溶液反应,最多消耗5mol NaOH | |
| D. | 1 mol β-紫罗兰酮 ( 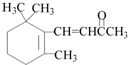 )与1 mol Br2发生加成反应可得到2种不同产物 )与1 mol Br2发生加成反应可得到2种不同产物 |
18.以下转化不能通过一步反应实现的是( )
| A. | SiO2→SiF4 | B. | Al2O3→Al(OH)3 | C. | Fe→FeCl2 | D. | SiO2→CaSiO3 |
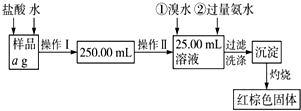 某氯化铁样品含有少量FeCl2杂质.现要测定其中铁元素的质量分数,实验按以下步骤进行:请根据流程,回答以下问题:
某氯化铁样品含有少量FeCl2杂质.现要测定其中铁元素的质量分数,实验按以下步骤进行:请根据流程,回答以下问题: