题目内容
【题目】下列说法正确的是
A.25 ℃水的电离常数是1.0×10-12
B.中性溶液的c(H+)=![]()
C.纯水在100 ℃时,c(H+)>10-7 mol·L-1,所以此时纯水中c(H+)>c(OH-)
D.pH<7的溶液一定是酸溶液
【答案】B
【解析】
A.温度为25℃,纯水中c(H+)=c(OH-)=1×10-7mol/L,c(H2O)=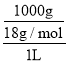 =55.6mol/L,则水的电离常数是
=55.6mol/L,则水的电离常数是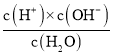 =
=![]() ≈1.79×10-12,故A错误。
≈1.79×10-12,故A错误。
B.已知Kw=c(H+)×c(OH-),中性溶液中c(H+)=c(OH-),则c(H+)=![]() ,故B正确;
,故B正确;
C.温度升高到100℃,水的电离度增大,则c(H+)=c(OH-)>10-7mol/L,但c(H+)和c(OH-)仍相等,故C错误;
D.温度未知,pH<7的溶液不一定呈酸性,可能呈中性或碱性,如100℃时中性溶液pH=6,故D错误;
故答案为B。

【题目】用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是
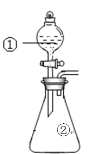
选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B. | 浓硝酸 | 用砂纸打磨过的铁片 | 产生红棕色气体 |
C. | 氯化铵溶液 | 氢氧化镁沉淀 | 白色沉淀溶解 |
D. | 碳酸氢钠溶液 | 苯酚钠溶液 | 溶液变浑浊 |
A.AB.BC.CD.D
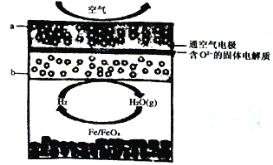
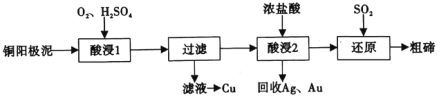
【题目】将绿矾(FeSO47H2O)隔绝空气条件下加强热分解,已知产物全部为氧化物,为探究绿矾分解的反应产物,某同学进行了以下实验:
(实验一)为探究固体产物中铁元素的价态,该同学将固体产物溶于足量的稀硫酸得到相应的溶液,进行以下猜想和实验:
猜想 | 实验操作 | 预期现象 |
猜想一:铁元素只显_______价 | ① 取溶液样品,滴入KSCN溶液;②取溶液样品,滴入稀酸性KMnO4溶液 | 加入KSCN溶液无明显现象稀酸性KMnO4溶液颜色______ |
猜想二:铁元素只显_______价 | 加入KSCN溶液呈______色;稀酸性KMnO4溶液颜色无变化 | |
猜想三:铁元素显+2,+3价 | 加入KSCN溶液呈血红色;稀酸性KMnO4溶液颜色褪色 |
(实验二)为进一步探究该反应的产物,进行了如下图所示的实验:
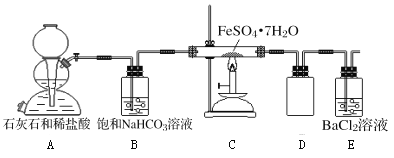
(1)实验开始时,点燃C处酒精喷灯之前应先打开A处活塞通CO2,其目的是_________。
(2)饱和NaHCO3的作用是______,其水溶液呈碱性的原因(用离子方程式解释)____________。
(3)该组同学称取了55.6克绿矾按如图装置进行试验,待绿矾分解完全后,E瓶中只出现白色沉淀且质量为23.3克;C中固体产物加入足量稀硫酸中,固体产物全部溶解,取溶液样品,加入KSCN,溶液呈血红色,取另一份溶液,加入酸性KMnO4,不褪色。根据这些实验现象和数据,可以得知绿矾分解的化学方程式为____________________________。
(4)该组同学设计的装置存在着一个明显的缺陷是__________________________。