题目内容
【题目】将绿矾(FeSO47H2O)隔绝空气条件下加强热分解,已知产物全部为氧化物,为探究绿矾分解的反应产物,某同学进行了以下实验:
(实验一)为探究固体产物中铁元素的价态,该同学将固体产物溶于足量的稀硫酸得到相应的溶液,进行以下猜想和实验:
猜想 | 实验操作 | 预期现象 |
猜想一:铁元素只显_______价 | ① 取溶液样品,滴入KSCN溶液;②取溶液样品,滴入稀酸性KMnO4溶液 | 加入KSCN溶液无明显现象稀酸性KMnO4溶液颜色______ |
猜想二:铁元素只显_______价 | 加入KSCN溶液呈______色;稀酸性KMnO4溶液颜色无变化 | |
猜想三:铁元素显+2,+3价 | 加入KSCN溶液呈血红色;稀酸性KMnO4溶液颜色褪色 |
(实验二)为进一步探究该反应的产物,进行了如下图所示的实验:
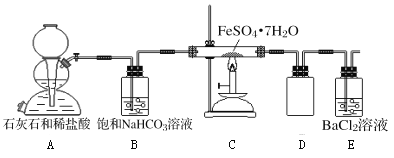
(1)实验开始时,点燃C处酒精喷灯之前应先打开A处活塞通CO2,其目的是_________。
(2)饱和NaHCO3的作用是______,其水溶液呈碱性的原因(用离子方程式解释)____________。
(3)该组同学称取了55.6克绿矾按如图装置进行试验,待绿矾分解完全后,E瓶中只出现白色沉淀且质量为23.3克;C中固体产物加入足量稀硫酸中,固体产物全部溶解,取溶液样品,加入KSCN,溶液呈血红色,取另一份溶液,加入酸性KMnO4,不褪色。根据这些实验现象和数据,可以得知绿矾分解的化学方程式为____________________________。
(4)该组同学设计的装置存在着一个明显的缺陷是__________________________。
【答案】+2价 褪色 +3价 血红色 赶走装置内的空气 除去CO2中的HCl HCO3-+H2O![]() H2CO3+OH- FeSO47H2O
H2CO3+OH- FeSO47H2O![]() Fe2O3+SO2↑+SO3↑+14H2O 未进行尾气处理
Fe2O3+SO2↑+SO3↑+14H2O 未进行尾气处理
【解析】
实验一,Fe元素有+2价、+3价,所以产物可能为Fe2(SO4)3、FeSO4或Fe2(SO4)3和FeSO4的混合物,铁元素化合价可能是+2价,+3价,或+2,+3价;①向所得溶液中滴入KSCN溶液;②向稀酸性KMnO4溶液中滴入所得溶液.KSCN溶液无明显现象,稀酸性KMnO4溶液颜色褪去,证明只含有Fe2+;稀酸性KMnO4溶液颜色无变化,证明一定是+3价铁元素;若KSCN溶液出现血红色现象,稀酸性KMnO4溶液颜色褪去,证明Fe元素既有+2价又有+3价;所以答案为+2价,褪色,+3价,血红色
实验二:(1)实验开始时,点燃C处酒精喷灯之前应先打开A处活塞通CO2,目的是赶走装置内的空气,避免影响测定结果;
(2)由石灰石和盐酸反应制取的CO2气体中有HCl杂质,必须除去,所以饱和碳酸氢钠溶液的作用是除去CO2中的HCl;NaHCO3溶液是弱酸的酸式盐,HCO3-的水解程度大于其电离程度,导致其溶液呈碱性,用离子方程式表示为HCO3-+H2O![]() H2CO3+OH-;
H2CO3+OH-;
(3)55.6克绿矾FeSO47H2O的物质的量是0.2摩尔,其中A中产生的二氧化碳是不会和氯化钡反应生成沉淀的,二氧化硫也不和氯化钡产生沉淀;所以,产生的沉淀就只能是硫酸钡,也就是说,一定会有三氧化硫产生,根据沉淀的质量是23.3克,所以硫酸钡的物质的量是0.1摩尔,所以产生的三氧化硫是0.1摩尔,根据原子守恒,在绿矾中的硫是0.2摩尔,剩余的0.1摩尔的硫可能有很多的生成形式,可能是单质硫,也可以使其他形态的硫,但是C瓶中并没有单质硫析出;不管是那种形态的硫存在,硫元素化合价一定降低了,所以铁元素化合价一定要升高,根据电子守恒计算,0.2molFe2+变化为Fe3+;硫元素化合价从+6价变化为x价,0.2×1=0.1×(6-x),x=+4,所以实验生成的产物中有SO2,依据原子守恒配平书写化学方程式为FeSO47H2O![]() Fe2O3+SO2↑+SO3↑+14H2O;
Fe2O3+SO2↑+SO3↑+14H2O;
(4)分析装置生成的气体中二氧化硫有毒不能排放到空气中需要尾气吸收;则答案为未进行尾气吸收;

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案