题目内容
【题目】碲(52Te)被誉为“国防与尖端技术的维生素”。工业上常用铜阳极泥(主要成分是Cu2Te、含Ag、Au等杂质)为原料提取碲并回收金属,其工艺流程如图:
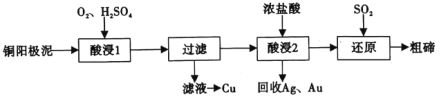
已知:TeO2微溶于水,易与较浓的强酸、强碱反应。回答下列问题:
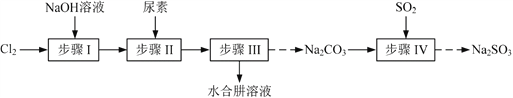
(1)已知Te为VIA族元素,TeO2被浓NaOH溶液溶解,所生成盐的化学式为___。
(2)“酸浸1”过程中,为加快浸出速率,可采取的方法有___(填1种)。“酸浸2”时温度过高会使Te的浸出率降低,原因是___。
(3)“酸浸1”过程中,控制溶液的酸度使Cu2Te转化为TeO2,反应的化学方程式为___;“还原”过程中,发生反应的离子方程式为___。
(4)工业上也可用电解法从铜阳极泥中提取碲,方法是:将铜阳极泥在空气中焙烧使碲转化为TeO2,再用NaOH溶液碱浸,以石墨为电极电解所得溶液获得Te。电解过程中阴极上发生反应的电极方程式为___。在阳极区溶液中检验出有TeO42-存在,生成TeO42-的原因是___。
(5)常温下,向lmol·L-1 Na2TeO3溶液中滴加盐酸,当溶液pH=5时,c(TeO32-):c(H2TeO3)=___。(已知:H2TeO3的Ka1=1.0×10-3 Ka2=2.0×10-8)
【答案】Na2TeO3 升高温度、增大压强、加快搅拌速度 温度过高会使盐酸挥发,降低盐酸的浓度,使Te的浸出率降低 Cu2Te+2O2+2H2SO4=2CuSO4+TeO2+2H2O ![]()
![]() TeO32-在阳极失电子,生成TeO42-
TeO32-在阳极失电子,生成TeO42- ![]() 或0.2
或0.2
【解析】
(1)Te与S同主族,结合SO2与氢氧化钠反应书写TeO2与浓NaOH溶液反应生成盐的化学式。
(2)根据影响反应速率的因素分析加快浸出速率的方法。 “酸浸2”时温度过高会使盐酸挥发,降低反应物的浓度。
(3)“酸浸1”过程中,控制溶液的酸度使Cu2Te与氧气、硫酸反应生成硫酸铜和TeO2;“还原”过程中,四氯化蹄与二氧化硫反应生成单质蹄和硫酸。
(4)再用NaOH溶液碱浸TeO2,得Na2TeO3,以石墨为电极电解Na2TeO3溶液获得Te。TeO32-在阴极得电子还原成Te单质。TeO32-在阳极失电子发生氧化反应生成TeO42-。
(5)根据H2TeO3的电离平衡常数表达式计算溶液pH=5时,c(TeO32-):c(H2TeO3)的值。
(1)Te与S同主族, SO2与氢氧化钠反应生成Na2SO3,所以TeO2与浓NaOH溶液反应生成盐的化学式为Na2TeO3。
(2)升高温度、增大压强、加快搅拌速度都能加快浸出速率。 “酸浸2”时温度过高会使盐酸挥发,降低盐酸的浓度,使Te的浸出率降低。
(3)“酸浸1”过程中,控制溶液的酸度使Cu2Te与氧气、硫酸反应生成硫酸铜和TeO2,反应的方程式是Cu2Te+2O2+2H2SO4=2CuSO4+TeO2+2H2O;“还原”过程中,四氯化蹄与二氧化硫反应生成单质蹄和硫酸,反应的离子方程式是![]() 。
。
(4)用NaOH溶液碱浸TeO2得Na2TeO3,以石墨为电极电解Na2TeO3溶液。TeO32-在阴极得电子还原成Te单质,阴极反应式是![]() 。TeO32-在阳极失电子发生氧化反应生成TeO42-。
。TeO32-在阳极失电子发生氧化反应生成TeO42-。
(5)H2TeO3的电离平衡常数 ,
, ,当溶液pH=5时,c(TeO32-):c(H2TeO3)=
,当溶液pH=5时,c(TeO32-):c(H2TeO3)= 。
。

【题目】下列实验中的现象,与氧化还原反应无关的是
A | B | C | D | |
实验 | 酒精溶液滴入高锰酸钾溶液中 | 石蕊溶液滴入氯水中 |
| 常温下,铝片插入浓硫酸中 |
现象 | 高锰酸钾溶液褪色 | 溶液变红,随后迅速褪色 | 沉淀由黄色逐渐变为黑色 | 无明显现象 |
A.AB.BC.CD.D