题目内容
8.A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增.已知:B原子核外最外层电子数是次外层电子数的两倍,电子总数是E原子总数的1/2,F是同周期元素中原子半径最小的元素;D2-与E2+的电子层结构相同.B与D可以形成三原子化合物甲.A是非金属元素,且A、C、F可形成离子化合物乙.请回答:(1)C单质的电子式
 ,F元素原子的电子排布式1s22s22p63s23p5,
,F元素原子的电子排布式1s22s22p63s23p5,(2)化合物乙中含有的化学键类型是离子键、极性共价键、配位键
(3)化合物甲中B原子的杂化类型是sp杂化.
分析 B原子核外最外层电子数是次外层电子数的两倍,应为C元素;B的电子总数是E原子总数的1/2,故E元素电子总数为:6×2=12,故E应为Mg元素;F是同周期元素中原子半径最小的元素,F位于第三周期,应为Cl元素,D2-与E2+的电子层结构相同,则D应为O元素;C的核电荷数介于B、D之间,则C为N元素;A是非金属元素,且A、C、F可形成离子化合物乙,可知A为H元素,乙为氯化铵,结合对应单质、化合物的性质解答该题.
解答 解:B原子核外最外层电子数是次外层电子数的两倍,应为C元素;B的电子总数是E原子总数的1/2,故E元素电子总数为:6×2=12,故E应为Mg元素;F是同周期元素中原子半径最小的元素,F位于第三周期,应为Cl元素,D2-与E2+的电子层结构相同,则D应为O元素;C的核电荷数介于B、D之间,则C为N元素;A是非金属元素,且A、C、F可形成离子化合物乙,可知A为H元素,乙为氯化铵,
依据分析可知A为H、B为C,C为N、D为O、E为Mg、F为Cl,
(1)C单质为氮气,氮气是由三对共价键构成的分子,其电子式为: ;F为Cl,其核外电子总数为17,Cl原子的电子排布式为:1s22s22p63s23p5,
;F为Cl,其核外电子总数为17,Cl原子的电子排布式为:1s22s22p63s23p5,
故答案为: ;1s22s22p63s23p5;
;1s22s22p63s23p5;
(2)化合物乙为NH4Cl,NH4Cl中含有离子键、极性共价键和配位键,
故答案为:离子键、极性共价键、配位键;
(3)B与D可以形成三原子化合物甲,则甲为二氧化碳,二氧化碳为直线形结构,二氧化碳分子中碳原子含有2个共价单键且不含孤电子对,所以碳原子为sp杂化,
故答案为:sp杂化.
点评 本题考查位置结构与性质关系的应用,为高考常见题型,题目难度中等,元素的推断是解答本题的关键,在推断中抓住“短周期”、核电荷数依次递增”等重要信息,注意掌握元素周期表结构、元素周期律内容.

| A. | 4.0 g重水(D2O)中所含质子数为0.4NA | |
| B. | 4.48 L N2与CO的混合物中所含分子数为0.2NA | |
| C. | 6.2 g白磷与红磷的混合物中所含磷原子数为0.2NA | |
| D. | 12.5 mL 16 mol•L-1浓硫酸与足量铜反应,转移电子数为0.2NA |
| A. | 元素原子的最外层电子数等于主族族序数 | |
| B. | 都既有正化合价、又有负化合价 | |
| C. | 元素的最高正价数不一定等于原子最外层电子数 | |
| D. | 最低负价数的绝对值等于原子形成稳定结构所需电子数 |
| A. | 非金属元素构成的单质中一定存在共价键 | |
| B. | 非金属元素构成的化合物一定是共价化合物 | |
| C. | 离子化合物中一定含有离子键 | |
| D. | 一种化合物中只能存在一种类型的化学键 |
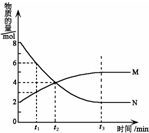 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图所示.下列叙述中,正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图所示.下列叙述中,正确的是( )| A. | 该反应的化学方程式为2 M?N | |
| B. | t1时N的浓度是M浓度的2倍 | |
| C. | t2时正逆反应速率相等,反应达到平衡状态 | |
| D. | t3时正反应速率大于逆反应速率 |
| A. | Na | B. | Mg | C. | Ag | D. | Fe |
| A. | 原子半径逐渐增大 | B. | 原子的得电子能力逐渐减弱 | ||
| C. | 最高正化合价逐渐减小 | D. | 元素的金属性逐渐减弱 |


