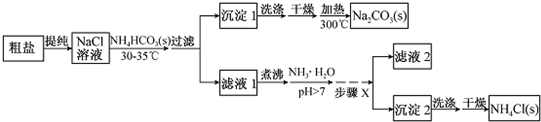
题目内容
10.在H2SO4、Cu、Na2SO4、C(石墨)、C2H5OH(酒精)、NaHSO4、NaCl等纯净物中,在常温下能导电的是Cu、C(石墨).属于电解质的是H2SO4、Na2SO4、NaHSO4、NaCl.分析 物质导电的条件:含有自由电子或者自由移动的离子;在水溶液里或熔融状态下能导电的化合物是电解质,在水溶液里和熔融状态下都不能导电的化合物是非电解质,注意单质、混合物都不是电解质,也不是非电解质,据此解答.
解答 解:H2SO4中不含有自由电子或者自由移动的离子,不导电;在水溶液能导电,属于电解质;
Cu含有自由电子电子,能够导电;但是属于单质,不是电解质;
Na2SO4中不含有自由电子或者自由移动的离子,不导电;在水溶液里或熔融状态下能导电的化合物是电解质;
C(石墨)含有自由电子电子,能够导电;属于单质,不是电解质;
C2H5OH(酒精)不含有自由电子或者自由移动的离子,不导电;在水溶液里和熔融状态下都不能导电是非电解质;
NaHSO4不含有自由电子或者自由移动的离子,不导电;在水溶液里或熔融状态下能导电的化合物是电解质;
NaCl不含有自由电子或者自由移动的离子,不导电;在水溶液里或熔融状态下能导电的化合物是电解质;
所以在常温下能导电的是:Cu、C(石墨);
属于电解质的是:H2SO4、Na2SO4、NaHSO4、NaCl;
故答案为:Cu、C(石墨);H2SO4、Na2SO4、NaHSO4、NaCl;
点评 本题考查了物质导电的条件、电解质的判断,明确电解质的概念是解题关键,注意单质、混合物都不是电解质,也不是非电解质.

练习册系列答案
相关题目
20.在一定温度下,容积一定的密闭容器中发生反应A(s)+2B(g)?C(g)+D(g),当下列物理量不再发生变化时,表明反应已达平衡的是( )
①混合气体的密度②混合气体的压强③B的物质的量浓度④混合气体的总物质的量.
①混合气体的密度②混合气体的压强③B的物质的量浓度④混合气体的总物质的量.
| A. | ①② | B. | ②③ | C. | ①③ | D. | ①④ |
1.NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 0.84 g NaHCO3晶体中阳离子和阴离子总数为0.03 NA | |
| B. | a g O2和O3的混合气体中所含分子数一定为$\frac{a}{32}$NA | |
| C. | 1.8 g H2O含有的质子数为NA | |
| D. | 标准状况下,2.24 L CCl4含碳原子数为0.1 NA |
5.下列说法正确的是( )
| A. | t℃时,某溶液的pH=6,则该溶液一定为酸性 | |
| B. | 常温下,将pH=11的氨水稀释后,溶液中所有离子的浓度均降低 | |
| C. | 把1L 0.1mol/L醋酸溶液用蒸馏水稀释到10L,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的比值增大 | |
| D. | 常温下,硫酸铝在水溶液中的电离方程式为:Al2(SO4)3?2Al3++3SO42- |
5.某同学设计aCO2(g)+bH2(g)?cCH3OH(g)+d D(g)(注:D物质未知)来生产甲醇CH3OH,为探究其反应原理进行如下实验,在2L密闭容器内250℃条件下,测得n(CO2)随时间的变化情况如下:
若已知从开始到刚达平衡时用H2表示的平均反应速率是0.05mol/(L•S),平衡时CH3OH的浓度是0.05mol/L,则:
(1)则a与b的关系是?(请写出计算过程,没有计算过程不得分)
(2)请补全反应方程式
1 CO2(g)+3H2(g)?1CH3OH(g)+1H2O(g)
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(CO2)(mol) | 0.40 | 0.35 | 0.31 | 0.3 | 0.3 | 0.3 |
(1)则a与b的关系是?(请写出计算过程,没有计算过程不得分)
(2)请补全反应方程式
1 CO2(g)+3H2(g)?1CH3OH(g)+1H2O(g)
3.18O是氧的一种同位素,下列说法正确的是( )
| A. | 18O原子所含中子数为8 | |
| B. | 1mol的1H218O分子所含质子数为12个 | |
| C. | 18O2气体的摩尔体积为22.4L/mol | |
| D. | 18O2气体的摩尔质量为36g/mol |
 .
.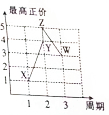 X、Y、Z、W、V是五种短周期主族元素,部分元素的周期序数与最高正价的关系如图所示.已知V元素的原子序数是下一周期同族元素的原子序数的一半.
X、Y、Z、W、V是五种短周期主族元素,部分元素的周期序数与最高正价的关系如图所示.已知V元素的原子序数是下一周期同族元素的原子序数的一半.