题目内容
18.有X、Y、Z三种元素,均位于元素周期表中的第三周期,X元素原子核外K层、L层电子数之和比L层、M层电子数之和多1个电子.Y元素的-2价阴离子与氩原子的电子层结构相同.Z元素的原子在此三种元素中原子半径最小,据此回答:
(1)X的简单阳离子的结构示意图为
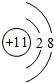 .
.(2)按酸性增强的顺序,写出Y、Z三种元素最高价氧化物对应水化物的化学式H2SO4、HClO4.
(3)按稳定性由强到弱顺序,写出Y和Z两元素气态氢化物的化学式HCl、H2S.
(4)在Y、Z两元素形成的简单阴离子的还原性强弱关系为S2->Cl-.
分析 X、Y、Z三种元素,均位于元素周期表中的第三周期,X元素原子核外K层、L层电子数之和比L层、M层电子数之和多1个电子,则X最外层电子数是1,为Na元素;
Y元素的-2价阴离子与氩原子的电子层结构相同,则Y是S元素;
Z元素的原子在此三种元素中原子半径最小,则Z为Cl元素;
(1)X的简单阳离子是钠离子,其原子核外有10个电子;
(2)元素的非金属性越强,其最高价氧化物的水化物酸性越强,其最高价与其族序数相等;
(3)元素的非金属性越强,其氢化物的稳定性越强,其最低负价=族序数-8;
(4)元素的金属性越强,其简单阴离子的还原性越弱.
解答 解:X、Y、Z三种元素,均位于元素周期表中的第三周期,X元素原子核外K层、L层电子数之和比L层、M层电子数之和多1个电子,则X最外层电子数是1,为Na元素;
Y元素的-2价阴离子与氩原子的电子层结构相同,则Y是S元素;
Z元素的原子在此三种元素中原子半径最小,则Z为Cl元素;
(1)X的简单阳离子是钠离子,其原子核外有10个电子,钠离子结构示意图为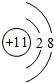 ,故答案为:
,故答案为: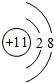 ;
;
(2)元素的非金属性越强,其最高价氧化物的水化物酸性越强,其最高价与其族序数相等,非金属性Cl>S,则其最高价氧化物的水化物酸性增强顺序是H2SO4、HClO4,故答案为:H2SO4、HClO4;
(3)元素的非金属性越强,其氢化物的稳定性越强,其最低负价=族序数-8,非金属性Cl>S,则其氢化物稳定性强弱顺序是HCl、H2S,故答案为:HCl、H2S;
(4)元素的金属性越强,其简单阴离子的还原性越弱,非金属性Cl>S,则其简单阴离子还原性强弱关系为S2->Cl-,故答案为:S2->Cl-.
点评 本题考查位置结构性质相互关系及应用,为高频考点,涉及非金属性强弱判断,正确判断元素是解本题关键,知道非金属性强弱与其氢化物稳定性、最高价氧化物的水化物酸性、简单阴离子还原性关系,题目难度不大.

 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案| A. | KBr | B. | HCl | C. | I2 | D. | NaOH |
| A. | Ba2+、NO3-、NH4+、Cl- | B. | Ca2+、HCO3-、NH4+、AlO2- | ||
| C. | K+、Ba2+、Cl-、HSO3- | D. | Na+、NH4+、SO42-、K+ |
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
(2)比较此时正、逆反应速率的大小:v正>v逆,理由是浓度商Qc=$\frac{0.6×0.6}{0.4{4}^{2}}$=1.36<K=400,反应向正反应进行.
(3)前5min时,用CH3OCH3表示该反应的速率为0.12mol/(L.min).
(4)再过一段时间后,反应达到平衡状态.能判断该反应已达到化学平衡状态的依据是B(填字母).
A.容器中压强不变 B.混合气体中c(CH3OH)不变
C.v生成(CH3OH)=2v消耗(H2O) D.c(CH3OCH3)=c (H2O)
(5)达到平衡状态时,CH3OH的转化率97.6%(计算结果保留到小数点后1位).
| A. | 11.2L NO2含氧原子数为NA | |
| B. | 标准状况下,14g CO所含质子数为7NA | |
| C. | 22g某气体含分子数为0.5NA,则其摩尔质量为44 | |
| D. | 25℃,101KPa条件下,1.4g N2的体积为1.12L |
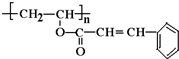
 ;
; 、
、 ,且苯环上有两个对位取代基的结构简式是
,且苯环上有两个对位取代基的结构简式是 .
.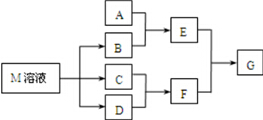 某课外学习小组对日常生活中不可缺少的调味品M进行探究.已知C可在D中燃烧发出苍白色火焰.M与其他物质的转化关系如下图所示(部分产物已去):
某课外学习小组对日常生活中不可缺少的调味品M进行探究.已知C可在D中燃烧发出苍白色火焰.M与其他物质的转化关系如下图所示(部分产物已去):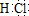 .
.
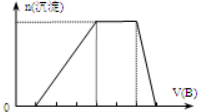
 在500℃下,向某恒容密闭容器中投入amolA2和bmolB2发生可逆反应A2(g)+B2(g)?2AB(g),△H>0,AB的物质的量与时间关系如图所示:
在500℃下,向某恒容密闭容器中投入amolA2和bmolB2发生可逆反应A2(g)+B2(g)?2AB(g),△H>0,AB的物质的量与时间关系如图所示: