题目内容
【题目】碳、氮广泛的分布在自然界中,碳、氮的化合物性能优良,在工业生产和科技领域有重要用途。
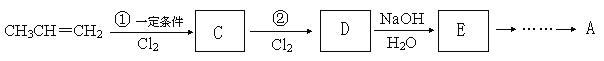
(1)氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300~1700oC的氮气流中反应制得:3SiO2(s)+6C(s)+2N2(g) ![]() Si3N4(s)+6CO(g)。⊿H =-1591.2 kJ/mol,则该反应每转移1mole—,可放出的热量为 。
Si3N4(s)+6CO(g)。⊿H =-1591.2 kJ/mol,则该反应每转移1mole—,可放出的热量为 。
(2)某研究小组现将三组CO(g)与H2O(g)的混合气体分别通入体积为2L的恒容密闭容器中,一定条件下发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:
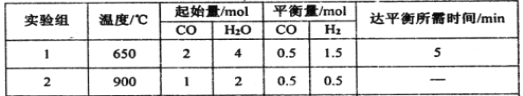
① 实验1中,前5min的反应速率v(CO2)= 。
②下列能判断实验2已经达到平衡状态的是 。
a.容器内CO、H2O、CO2、H2的浓度不再变化 b.容器内压强不再变化
c.混合气体的密度保持不变 d.v正(CO) =v逆(CO2)
e.容器中气体的平均相对分子质量不随时间而变化
③若实验2的容器是绝热的密闭容器,实验测得H2O(g)的转化率H2O%随时间变化的示意图如下图所示, b点v正 v逆(填“<”、“=”或“>”),t3~t4时刻,H2O(g)的转化率H2O%降低的原因是 。

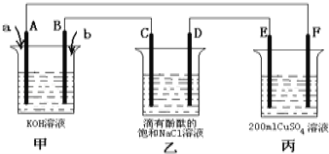
(3)利用CO与H2可直接合成甲醇,下图是由“甲醇-空气”形成的绿色燃料电池的工作原理示意图,写出以石墨为电极的电池工作时负极的电极反应式 ,利用该电池电解1L 0.5mol/L的CuSO4溶液,当消耗560mLO2(标准状况下)时,电解后溶液的pH= (溶液电解前后体积的变化忽略不计)。

【答案】(1)132.6kJ(2)① 0.15mol·L-1·min-1 ②ad ③>、该反应达到平衡后,因反应为放热反应且反应容器为绝热容器,故容器内温度升高,反应逆向进行
(3)CH3OH-6e-+H2O=CO2+6H+、1
【解析】
试题分析:(1)反应中氮元素的化合价从0价降低到-3价,得到电子,所以氮气是氧化剂,2mol氮气得到12mol电子,放出1591.2kJ的热量,则该反应每转移1mole—,可放出的热量为1591.2 kJ÷12=132.6kJ。
(2)①根据表格提供的信息和化学方程式可知v(CO2)=v(H2),则v(CO2 )=v(H2)=1.5mol÷(2L×5min)= =0.15mol/(Lmin);
②a.容器内CO、H2O、CO2、H2的浓度不再变化是反应达到平衡状态的标志,a正确;b.由于反应前后气体的体积不变,则无论是否达到平衡状态容器内压强始终不改变,压强不变不能作为判断达到平衡的依据,b错误;c.在恒容密闭容器中,混合气体的密度始终保持不变,不能作为判断达到平衡状态的依据,c错误;d.v正(CO) =v逆(CO2),说明正、逆反应速率相等,反应达到平衡状态,d正确;e.根据M=m÷n,该反应是左右气体系数和相等的可逆反应,密闭容器中质量不变,则气体的平均相对分子质量始终不随时间而变化,不能作为达到平衡状态的依据,e错误;答案选ad。
③根据图象可知,b点过后水的转化率增大,说明平衡正向移动,即b点v正 > v逆;因为该反应达到平衡后,因反应为放热反应且反应容器为绝热容器,故容器内温度升高,反应逆向进行,t3~t4时刻,H2O(g)的转化率H2O%降低。
(3)根据题图可知,甲醇在负极上发生氧化生成CO2,电极反应式为CH3OH-6e-+H2O=CO2+6H+;标准状况下560mLO2的物质的量为0.56L÷22.4/mol=0.025mol,氧气在正极得到的电子的物质的量为0.025mol×4=0.1mol,则整个电路中转移0.1mol电子,根据阳极反应式:2H2O-4e-=O2↑+4H+,电解后溶液的c(H+)=0.1mol÷1L=0.1mol/L,pH=1。

 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案