题目内容
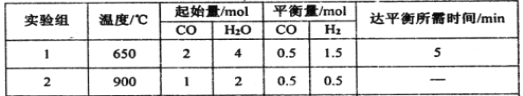
【题目】把下列物质分别加入盛冷水的锥形瓶内,立即塞紧带U形管的塞子。已知U形管内预先装有少量水且液面相平(为便于观察,预先染成红色),加入下列
哪些物质后,发生如图变化( )

①NaOH粉末;②浓硫酸;③硝酸铵晶体;④过氧化钠固体;⑤生石灰
A.①②④⑤ B.①②③ C.②③⑤ D.③④⑤
【答案】A
【解析】
试题分析:U形管中现象的实质是锥形瓶内的气压高于大气压,锥形瓶内气压增大的原因,可能是化学反应生成了气体,也可能是物质溶解或化学反应放出热量,还可能是既生成气体又放出热量。①NaOH粉末溶于水放热,锥形瓶内的气体压强增大,符合题意;②浓硫酸溶于水放热,锥形瓶内的气体压强增大,符合题意;③硝酸铵晶体溶于水吸收热量,锥形瓶内的气体压强减小,不符合题意;④Na2O2与H2O反应2Na2O2+2H2O═4NaOH+O2↑,生成O2并放出热量,锥形瓶内的气体压强增大,符合题意;⑤生石灰与H2O反应CaO+H2O=Ca(OH)2,放出热量锥形瓶内的气体压强增大,符合题意;答案选A。

 名校课堂系列答案
名校课堂系列答案【题目】3,5-二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5-二甲氧基苯酚的部分物理性质见下表:
物质 | 沸点/℃ | 熔点/℃ | 密度(20℃) / g·cm-3 | 溶解性 |
甲醇 | 64. 7 |
| 0. 7915 | 易溶于水 |
乙醚 | 34. 5 |
| 0. 7138 | 微溶于水 |
3,5-二甲氧基苯酚 |
| 33-36 |
| 易溶于甲醇、乙醚,微溶于水 |
反应结束后,先分离出甲醇,再加入乙醚进行萃取。
(1)①分离出甲醇的操作是的 。
②萃取用到的分液漏斗使用前需 并洗净,分液时有机层在分液漏斗的 填(“上”或“下”)层。
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3 溶液洗涤的目的是 ;用饱和食盐水洗涤的目的是 。
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是 (填字母)。
a.蒸馏除去乙醚 b.重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥