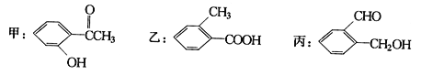
题目内容
【题目】【加试题】甲醇又称“木醇”或“木精”,沸点64.7℃,是无色有酒精气味易挥发的液体.甲醇有毒,误饮5~10mL能双目失明,大量饮用会导致死亡.甲醇是重要的化学工业基础原料和液体燃料,可用于制造甲醛和农药,并常用作有机物的萃取剂和酒精的变性剂等。
(1)工业上可利用CO2和H2生产甲醇,方程式如下:
CO2(g)+3H2(g)![]() CH3OH(l)+H2O(g) △H=Q1kJmol﹣1
CH3OH(l)+H2O(g) △H=Q1kJmol﹣1
又查资料得知:①CH3OH(l)+1/2O2(g)![]() CO2(g)+2H2(g) △H=Q2kJmol﹣1
CO2(g)+2H2(g) △H=Q2kJmol﹣1
②H2O(g)=H2O(l)△H=Q3kJmol﹣1,则表示甲醇的燃烧热的热化学方程式为 。
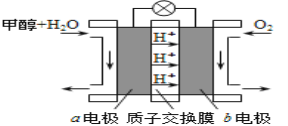
(2)甲醇燃料电池是符合绿色化学理念的新型燃料电池,下图是以甲醇燃料电池(甲池)为电源的电解装置.已知:A、B、C、D、E、F都是惰性电极,丙中为0.1mol/L CuSO4溶液 (假设反应前后溶液体积不变),当向甲池通入气体a和b时,D极附近呈红色.回答下列问题:
①a物质是 ,A电极的电极反应式为 。
②乙装置中的总化学反应方程式为 。
③当乙装置中C电极收集到224mL(标况下)气体时,丙中溶液的pH= 。

【答案】(1)CH3OH(l)+3/2O2(g)![]() CO2(g)+2H2O(l) △H=(2 Q1+3 Q2+2 Q3)kJmol﹣1;
CO2(g)+2H2O(l) △H=(2 Q1+3 Q2+2 Q3)kJmol﹣1;
(2)①甲醇,CH3OH-6e-+8OH- = CO32-+6H2O;②2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;③1.
2NaOH+H2↑+Cl2↑;③1.
【解析】
试题分析:(1)已知A.CO2(g)+3H2(g)![]() CH3OH(l)+H2O(g) △H=Q1kJmol﹣1;①CH3OH(l)+1/2O2(g)
CH3OH(l)+H2O(g) △H=Q1kJmol﹣1;①CH3OH(l)+1/2O2(g)![]() CO2(g)+2H2(g) △H=Q2kJmol﹣1;②H2O(g)=H2O(l)△H=Q3kJmol﹣1,由2a+3①+2②得:CH3OH(l)+3/2O2(g)
CO2(g)+2H2(g) △H=Q2kJmol﹣1;②H2O(g)=H2O(l)△H=Q3kJmol﹣1,由2a+3①+2②得:CH3OH(l)+3/2O2(g)![]() CO2(g)+2H2O(l) △H=(2 Q1+3 Q2+2 Q3)kJmol﹣1,答案为:CH3OH(l)+3/2O2(g)
CO2(g)+2H2O(l) △H=(2 Q1+3 Q2+2 Q3)kJmol﹣1,答案为:CH3OH(l)+3/2O2(g)![]() CO2(g)+2H2O(l) △H=(2 Q1+3 Q2+2 Q3)kJmol﹣1;(2)A、B、C、D、E、F都是惰性电极,乙中装的是滴有酚酞的饱和NaCl溶液,D极附近呈红色,那么D极发生的反应为2H2O+2e-=H2↑+2OH-,可以推出A为燃料电池的正极,B为燃料电池的负极,①a物质是甲醇,发生的电极反应为:CH3OH+6e-+8OH- = CO32-+6H2O,答案为:甲醇,CH3OH-6e-+8OH- = CO32-+6H2O;②乙装置中是电解饱和食盐水,反应方程式为:2NaCl+2H2O
CO2(g)+2H2O(l) △H=(2 Q1+3 Q2+2 Q3)kJmol﹣1;(2)A、B、C、D、E、F都是惰性电极,乙中装的是滴有酚酞的饱和NaCl溶液,D极附近呈红色,那么D极发生的反应为2H2O+2e-=H2↑+2OH-,可以推出A为燃料电池的正极,B为燃料电池的负极,①a物质是甲醇,发生的电极反应为:CH3OH+6e-+8OH- = CO32-+6H2O,答案为:甲醇,CH3OH-6e-+8OH- = CO32-+6H2O;②乙装置中是电解饱和食盐水,反应方程式为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,答案为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑,答案为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;③当乙装置中C电极的反应为:—2e- = Cl2↑, 生成224mL(标况下)气体时,转移的电子数为0.02mol,丙中E电极的电极反应式为: 2H2O-4e-=O2↑+4H+,转移0.002mol电子,产生的H+的物质的量为0.002mol,物质的量浓度为:0.02mol/0.2=0.1mol/L,pH为1,答案为1.
2NaOH+H2↑+Cl2↑;③当乙装置中C电极的反应为:—2e- = Cl2↑, 生成224mL(标况下)气体时,转移的电子数为0.02mol,丙中E电极的电极反应式为: 2H2O-4e-=O2↑+4H+,转移0.002mol电子,产生的H+的物质的量为0.002mol,物质的量浓度为:0.02mol/0.2=0.1mol/L,pH为1,答案为1.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】3,5-二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5-二甲氧基苯酚的部分物理性质见下表:
物质 | 沸点/℃ | 熔点/℃ | 密度(20℃) / g·cm-3 | 溶解性 |
甲醇 | 64. 7 |
| 0. 7915 | 易溶于水 |
乙醚 | 34. 5 |
| 0. 7138 | 微溶于水 |
3,5-二甲氧基苯酚 |
| 33-36 |
| 易溶于甲醇、乙醚,微溶于水 |
反应结束后,先分离出甲醇,再加入乙醚进行萃取。
(1)①分离出甲醇的操作是的 。
②萃取用到的分液漏斗使用前需 并洗净,分液时有机层在分液漏斗的 填(“上”或“下”)层。
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3 溶液洗涤的目的是 ;用饱和食盐水洗涤的目的是 。
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是 (填字母)。
a.蒸馏除去乙醚 b.重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
【题目】邻苯二甲酸丁基月桂酯是一种淡黄色透明油状液体,密度约0.97g/cm3,常用作聚氯乙烯等树脂的增塑剂。工业上生产原理和工艺流程如下:
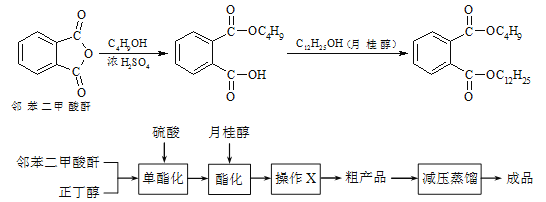
有关物质的物理性质见下表:
化合物 | 溶解性 | 熔点 | 沸点 |
邻苯二甲酸酐 | 微溶于冷水、乙醚,易溶于热苯、乙醇、乙酸 | 131.6℃ | 295℃ |
正丁醇 | 微溶于水,溶于乙醇、醚、多数有机溶剂 | -88.9℃ | 117.5℃ |
月桂醇 | 不溶于水,溶于醇、醚 | 24 | 259℃ |
邻苯二甲酸丁基月桂酯 | 不溶于水,溶于多数有机溶剂 | 不祥 | 202~210℃ |
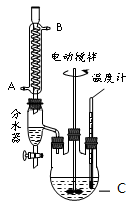
某实验小组的同学模拟工业生产的工艺流程,用右图所示装置制取少量邻苯二甲酸丁基月桂酯,图中夹持和加热装置已略去。主要操作步骤如下:
①向三颈烧瓶内加入30 g 邻苯二甲酸酐、16 g 正丁醇以及少量浓硫酸。
②搅拌,升温至105 ℃,持续搅拌反应1小时。
③冷却至室温,加入40 g 月桂醇,升温至160 ℃,搅拌、保温至反应结束。
④冷却至室温,将反应混合物倒出。
⑤通过工艺流程中的操作X,得到粗产品。
请回答下列问题:
(1)仪器C的名称___________。冷凝管中冷水应从___________进。
(2)步骤③中判断反应已结束的方法是___________。
(3)步骤⑤中操作X可除去少量未反应的邻苯二甲酸酐及正丁醇,操作X包括___________。
(4)工艺流程中减压蒸馏的目的是___________。
(5)实验结果表明步骤②、③产率都比较高,原因是___________。