��Ŀ����
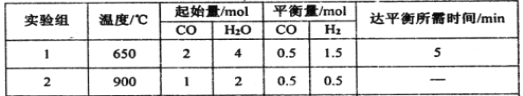
����Ŀ��I��һ���¶��£�ij�ݻ�Ϊ2 L���ܱ������ڣ�ijһ��Ӧ��M��N�����ʵ����淴Ӧʱ��仯����������ͼ����ͼ��ʾ��

��1���÷�Ӧ�Ļ�ѧ����ʽ��_____________________��
��2����ͼ����ʾ������ʱ���У�_______����t1��t2��t3��ʱ�̴ﵽ��ѧ��Ӧ����
II��һ���¶��½�6 mol A��6 mol B�����2 L���ܱ������У��������·�Ӧ��3A(g)+B(g)![]() xC(g)+2D(g)������5���Ӻ�Ӧ�ﵽƽ�⣬���A��ת����Ϊ60%��C��ƽ����Ӧ������0.36 mol/��L��min������
xC(g)+2D(g)������5���Ӻ�Ӧ�ﵽƽ�⣬���A��ת����Ϊ60%��C��ƽ����Ӧ������0.36 mol/��L��min������
��1��ƽ��ʱD��Ũ��=___________________��
��2��B��ƽ����Ӧ���ʦ�(B)= ___________________________��
��3��x=_________��
��4����ʼʱ�����е�ѹǿ��ƽ��ʱ��ѹǿ֮��Ϊ______________����Ϊ��������ȣ���
������I����1��2N![]() M��2��t3
M��2��t3
II����1��1.2 mol��L�C1��2��0.12 mol��L�C1��min�C1 ��3��3��4��12:13
��������
���������I����1������ͼ���֪��Ӧ���е�t2ʱ�̣�N�����ʵ�����8mol��Ϊ4mol��N�Ƿ�Ӧ�M��2mol��Ϊ4mol��M����������ߵı仯��֮����4mol��2mol��2��1�������÷�Ӧ�Ļ�ѧ����ʽ��2N![]() M��
M��
��2��ƽ��ʱ�������ʵ�Ũ�Ȳ��ٷ����仯������ͼ����ʾ������ʱ����t3ʱ�̴ﵽ��ѧ��Ӧ����
II������5���Ӻ�Ӧ�ﵽƽ�⣬���A��ת����Ϊ60%��������A��6mol��60%��3.6mol��C��ƽ����Ӧ������0.36 mol/��L��min����������C��0.36 mol/��L��min����2L��5min��3.6mol�����ʵı仯��֮������Ӧ�Ļ�ѧ������֮�ȣ���x��3�����
3A(g)+B(g)![]() 3C(g)+2D(g)
3C(g)+2D(g)
��ʼ����mol�� 6 6 0 0
ת������mol�� 3.6 1.2 3.6 2.4
ƽ������mol�� 2.4 4.8 3.6 2.4
����ƽ��ʱD��Ũ����2.4mol��2L��1.2 mol��L�C1��
B��ƽ����Ӧ���ʦ�(B)��![]() ��0.12 mol��L�C1��min�C1��
��0.12 mol��L�C1��min�C1��
��ͬ������ѹǿ֮�������ʵ���֮�ȣ�����ʼʱ�����е�ѹǿ��ƽ��ʱ��ѹǿ֮��Ϊ![]() ��
��

����Ŀ����������Ϫһ��2016���¿������мס��ҡ�����������5�����ʣ���һ�������£������ܰ���ͼ��ʽ����ת����

���ƶ���ȷ���� (�� ��)
ѡ�� | �� | �� | �� | �� | �� |
A | NH3 | O2 | NO | H2O | NO2 |
B | Mg | CO2 | C | MgO | CO |
C | C | H2O | CO | H2 | CO2 |
D | FeBr2 | Cl2 | FeCl2 | Br2 | FeCl3 |