题目内容
9.铝硅合金具有熔点低、凝固时收缩率小等优点,适合铸造.现取试样10.0mg,放在纯净氧气中完全燃烧,燃烧后的固体经称量发现比原来试样增重9.23mg,由此计算硅铝合金中硅的质量分数为( )| A. | 12.3% | B. | 15.4% | C. | 13.4% | D. | 17.0% |
分析 铝、硅燃烧涉及两个反应:4Al+3O2$\frac{\underline{\;点燃\;}}{\;}$2Al2O3,Si+O2$\frac{\underline{\;点燃\;}}{\;}$SiO2.固体增重质量就是参加反应的氧气的质量,因求物质的含量,所以可首先将单位调整为克,便于计算,即样品取10 g,反应后固体增重的质量为9.23 g,设Al、Si的物质的量分别为xmol、ymol,列方程计算各自物质的量,进而计算硅的质量分数.
解答 解:铝、硅燃烧涉及两个反应:4Al+3O2$\frac{\underline{\;点燃\;}}{\;}$2Al2O3,Si+O2$\frac{\underline{\;点燃\;}}{\;}$SiO2.固体增重质量就是参加反应的氧气的质量,因求物质的含量,所以可首先将单位调整为克,便于计算,即样品取10 g,反应后固体增重的质量为9.23 g,
设Al、Si的物质的量分别为xmol、ymol,则:
$\left\{\begin{array}{l}{27x+28y=10}\\{\frac{3}{4}x×32+32y=9.23}\end{array}\right.$
解得x≈0.32,y≈0.048
故硅的质量分数为$\frac{0.048mol×28g/mol}{10g}$×100%=13.4%,
故选:C.
点评 本题考查混合物有关计算,难度不大,但数据计算稍微繁琐,明确发生的反应即可解答.

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案
相关题目
19.下列物质中,属于高分子化合物的是( )
①蛋白质 ②氨基酸 ③油脂 ④淀粉 ⑤乙烷 ⑥纤维素 ⑦聚乙烯.
①蛋白质 ②氨基酸 ③油脂 ④淀粉 ⑤乙烷 ⑥纤维素 ⑦聚乙烯.
| A. | 只有①⑦ | B. | 除②外都是 | C. | 只有①④⑥⑦ | D. | 只有①③ |
20.下列式子是表示氨水中可能存在氢键:①O-H…N ②O-H…O ③N-H…N ④N-H…O.其中正确的是( )
| A. | ①②③④ | B. | ②③④ | C. | ①③ | D. | ②④ |
17. 已知苯环上与硝基相邻的卤原子的反应活性很强,易与NaOH溶液发生水解反应.有关如图所示化合物的说法不正确的是( )
已知苯环上与硝基相邻的卤原子的反应活性很强,易与NaOH溶液发生水解反应.有关如图所示化合物的说法不正确的是( )
 已知苯环上与硝基相邻的卤原子的反应活性很强,易与NaOH溶液发生水解反应.有关如图所示化合物的说法不正确的是( )
已知苯环上与硝基相邻的卤原子的反应活性很强,易与NaOH溶液发生水解反应.有关如图所示化合物的说法不正确的是( )| A. | 既可以催化加氢,又可以使酸性高锰酸钾溶液褪色 | |
| B. | 既可以与FeCl3溶液发生显色反应,又可以与Na2CO3溶液反应 | |
| C. | 1mol该化合物最多可以与7molNaOH反应 | |
| D. | 可以与Br2的CCl4溶液发生加成反应,但不可以在光照下与Br2发生取代反应 |
4.在一定温度下,10mL0.50mol/L H2O2发生催化分解.不同时刻测定生成O2的体积(已折算为标准状况)如下表.
下列叙述正确的是(溶液体积变化忽略不计)( )
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.1 |
| A. | 0~6 min的平均反应速率:v(H2O2)≈0.33 mol/(L•min) | |
| B. | 6~10 min的平均反应速率:v(H2O2)>3.3×10-2 mol/(L•min) | |
| C. | 反应到6 min时,H2O2分解了60% | |
| D. | 反应到10 min时,c(H2O2)≈0.24 mol/L |
14. 有关元素X、Y、Z、D、E的信息如下
有关元素X、Y、Z、D、E的信息如下
请回答下列问题:
(1)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.
(2)E元素与Y元素可形成EY2和EY3两种化合物,下列说法正确的是(填序号)①④.
①保存EY2溶液时,需向溶液加入少量E单质
②通常实验室配制EY3溶液时,直接用水溶解EY3固体即可
③EY2只能通过置换反应生成,EY3只能通过化合反应生成
④铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒
(3)用电子式表示D2Z的形成过程: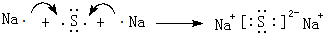 ,D2Z水溶液显碱性,用离子方程式表示其原因S2-+H2O?HS-+OH-
,D2Z水溶液显碱性,用离子方程式表示其原因S2-+H2O?HS-+OH-
(4)2009年3月,墨西哥、美国等多国连接暴发甲型H1N1型流感,防控专家表示,含Y消毒剂和过氧化物可防甲型H1N1流感.YO2是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KYO3在H2ZO4存在下与D2ZO3反应制得.请写出反应的离子方程式:2ClO3-+SO32-+2H+=2ClO2+SO42-+H2O.
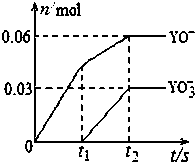
(5)将一定量的Y单质通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中
有三种含Y元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.该苛性钾溶液中KOH的质量是16.8g,该反应中转移电子的物质的量是0.21mol.
 有关元素X、Y、Z、D、E的信息如下
有关元素X、Y、Z、D、E的信息如下| 元素 | 有关信息 |
| X | 元素主要化合价为-2,原子半径为0.074nm |
| Y | 所在主族序数与所在周期序数之差为4 |
| Z | 原子半径为0.102nm,核外最外层电子数是其电子层数的2倍,其单质在X的单质中燃烧,产生的气体通入品红中,品红褪色. |
| D | 最高价氧化物对应的水化物,是强电解质,能电离出电子数相等的阴、阳离子 |
| E | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
(1)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.
(2)E元素与Y元素可形成EY2和EY3两种化合物,下列说法正确的是(填序号)①④.
①保存EY2溶液时,需向溶液加入少量E单质
②通常实验室配制EY3溶液时,直接用水溶解EY3固体即可
③EY2只能通过置换反应生成,EY3只能通过化合反应生成
④铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒
(3)用电子式表示D2Z的形成过程:
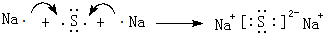 ,D2Z水溶液显碱性,用离子方程式表示其原因S2-+H2O?HS-+OH-
,D2Z水溶液显碱性,用离子方程式表示其原因S2-+H2O?HS-+OH-(4)2009年3月,墨西哥、美国等多国连接暴发甲型H1N1型流感,防控专家表示,含Y消毒剂和过氧化物可防甲型H1N1流感.YO2是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KYO3在H2ZO4存在下与D2ZO3反应制得.请写出反应的离子方程式:2ClO3-+SO32-+2H+=2ClO2+SO42-+H2O.
(5)将一定量的Y单质通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中
有三种含Y元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.该苛性钾溶液中KOH的质量是16.8g,该反应中转移电子的物质的量是0.21mol.
1.下列判断正确的是( )
①任何物质在水中都有一定的溶解度
②浊液用过滤的方法分离
③分散系一定是混合物
④丁达尔效应、布朗运动、渗析都是胶体的物理性质
⑤同一种溶质的饱和溶液要比不饱和溶液浓些
⑥布朗运动不是胶体所特有的运动方式
⑦任何溶胶加入可溶性电解质后都能使胶粒发生聚沉
⑧相同条件下,相同溶质的溶液,饱和溶液要比不饱和溶液浓些.
①任何物质在水中都有一定的溶解度
②浊液用过滤的方法分离
③分散系一定是混合物
④丁达尔效应、布朗运动、渗析都是胶体的物理性质
⑤同一种溶质的饱和溶液要比不饱和溶液浓些
⑥布朗运动不是胶体所特有的运动方式
⑦任何溶胶加入可溶性电解质后都能使胶粒发生聚沉
⑧相同条件下,相同溶质的溶液,饱和溶液要比不饱和溶液浓些.
| A. | ③⑥⑧ | B. | ②④⑥⑧⑦ | C. | ①②③④⑤ | D. | 全部不正确 |
18.具有以下结构的原子,一定属于主族元素的是( )
| A. | 最外层有3个未成对电子的原子 | B. | 最外层电子排布为ns2的原子 | ||
| C. | 次外层无未成对电子的原子 | D. | 最外层有8个电子的原子 |