题目内容
18.具有以下结构的原子,一定属于主族元素的是( )| A. | 最外层有3个未成对电子的原子 | B. | 最外层电子排布为ns2的原子 | ||
| C. | 次外层无未成对电子的原子 | D. | 最外层有8个电子的原子 |
分析 A、最外层有3个未成对电子的原子一定是第ⅤA族元素;
B、最外层电子排布为ns2的原子也可能是稀有气体或副族元素或第Ⅷ族元素;
C、次外层无未成对电子的原子,也可能是零族元素、副族元素;
D、最外层有8个电子的原子属于零族元素.
解答 解:A、最外层有3个未成对电子的原子一定是第ⅤA族元素,故A正确;
B、最外层电子排布为ns2的原子也可能是稀有气体或副族元素或第Ⅷ族元素,如He、Zn、Fe,故B错误;
C、次外层无未成对电子的原子,可能为主族元素,如O,可能为零族元素,如Ar,也可能是副族元素,例如锌等,故C错误;
D、最外层有8个电子的原子属于零族元素,故D错误;
故选A.
点评 本题考查主族元素的判断,侧重考查学生对元素周期表结构以及核外电子排布的熟悉了解程度,旨在巩固学生的基础.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.下列关于Na和Na+性质的叙述正确的是( )
| A. | 它们都显碱性 | B. | 它们都有强还原性 | ||
| C. | 它们都能跟H2O、O2反应 | D. | Na只有还原性,Na+只有氧化性 |
9.铝硅合金具有熔点低、凝固时收缩率小等优点,适合铸造.现取试样10.0mg,放在纯净氧气中完全燃烧,燃烧后的固体经称量发现比原来试样增重9.23mg,由此计算硅铝合金中硅的质量分数为( )
| A. | 12.3% | B. | 15.4% | C. | 13.4% | D. | 17.0% |
6.下列溶液中通入SO2无明显现象的是( )
| A. | Ba(OH)2 | B. | Ba(NO3)2 | C. | 溴水 | D. | BaCl2 |
7.按碳骨架分类,下列说法正确的是( )
| A. | 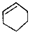 属于芳香族化合物 属于芳香族化合物 | B. | 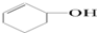 属于酚类化合物 属于酚类化合物 | ||
| C. | 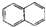 属于脂环化合物 属于脂环化合物 | D. | CH3CH(CH3)2属于链状化合物 |
8.下列变化属于物理变化的是( )
| A. | 煤的干馏 | B. | 石油裂解 | ||
| C. | 蛋白质中加入饱和NH4Cl析出晶体 | D. | 古代植物变成煤 |