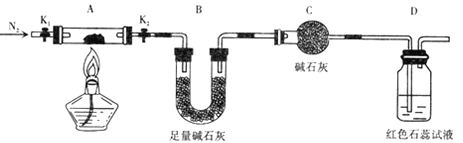
��Ŀ����
����Ŀ���״�����Ҫ�Ļ���ԭ�ϣ��ֿ���ȼ�ϡ�
I.��ҵ������CO����ȼ�ϼ״�����֪2H2(g)+CO(g) CH3OH(g)����
��1���ں��º��ݵĸ��������н��и÷�Ӧ����˵���ﵽƽ��״̬����____��(ѡ����ĸ���)
a.��������ܶȲ��ٸı�
b.�������ƽ��Ħ���������ٸı�
c.H2��CO��CH3OH��Ũ��֮��Ϊ2��1��1
d.��λʱ��������1molCO��ͬʱ����2molH2
��2�����ܱ������а����ʵ���֮��Ϊ2:1����H2��CO�����ƽ��������CH3OH����������ڲ�ͬѹǿ�����¶ȵı仯�����ͼ1��ʾ��
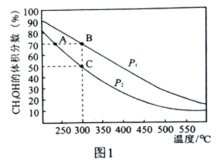
���淴Ӧ���ʣ�v��(A)__v��(B)(�>������<����"=��)
��C��ʱ��H2��ƽ��ת����Ϊ________________���÷�Ӧ��ƽ�ⳣ��Kp=____kPa��2(�ú�p2�Ĵ���ʽ���KPΪ������ƽ���ѹ��������ƽ��Ũ�ȱ�ʾ��ƽ�ⳣ���������ѹ=������ѹ����������ʵ�������)��
II.�״�ˮ������������(SRM)ϵͳ��������H2�����ߡ�CO������(CO����ȼ�ϵ�صĽ���Ĥ)���ǵ綯��������ȼ�ϵ�ص�������Դ����Ӧ���£�
��Ӧi(��)��CH3OH(g)+H2O(g) CO2(g)+3H2(g) ��H1=+49kJ��mol��1
��Ӧii(��)��H2(g)+CO2(g) CO(g)+H2O(g) ��H2=+41kJ��mol��1
�¶ȸ���300��C���ͬʱ������Ӧiii��CH3OH(g) CO(g)+2H2(g) ��H3
��3�������H3=____________.
��4�����½����������CH3OHת���ʣ���Ҳ����һ�����Ե�ȱ����____________��
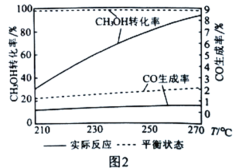
��5���������Ըı仯ѧ��Ӧ���ʣ���Ҳ������һ�����Խ���������ѡ��������ͼ2Ϊij���������£�CH3OHת���ʡ�CO���������¶ȵı仯��ϵ�������¶ȵ����ߣ�CO��ʵ�ʷ�Ӧ��������ƽ��״̬���������Խ��Խ���ԭ���Ǵ�����____________(������Ӧi����"��Ӧii��)��ѡ���Ե͡�
���𰸡�bd �� 75% ![]() +90kJmol-1 CO�������ߣ��ƻ�ȼ�ϵ�صĽ���Ĥ ��Ӧii
+90kJmol-1 CO�������ߣ��ƻ�ȼ�ϵ�صĽ���Ĥ ��Ӧii
��������
��(1)���淴Ӧ����ƽ��ʱ��ͬ�����ʵ�������������ұ��ֲ��䣬����ֵ�Ũ�ȡ��������ֲ��䣬�ɴ�����������һЩ�����䣬�ж�ƽ���������Ӧ�淴Ӧ���з����仯�����������ɱ仯�����ٱ仯˵������ƽ�⣻
(2)���¶���ͬʱ��p1���߶�Ӧ��CH3OH����������ϸߣ���˵������ѹǿƽ�����ƣ���p1��p2����B���¶ȸ���A���¶ȣ�
��C��ʱ��CH3OH���������Ϊ50%��

V(CH3OH)%=![]() ��100%=
��100%=![]() ��100%=50%�����x=0.75��ת������(H2)=
��100%=50%�����x=0.75��ת������(H2)=![]() ��100%��ƽ�ⳣ��KP=
��100%��ƽ�ⳣ��KP=![]() ��p(H2)=
��p(H2)=![]() ��p2��p(CO)=
��p2��p(CO)=![]() ��p2��p(CH3OH)=
��p2��p(CH3OH)=![]() ��p2��
��p2��
��(3)��֪����Ӧi(��)��CH3OH(g)+H2O(g)CO2(g)+3H2(g)��H1=+49kJmol-1
��Ӧii(��)��H2(g)+CO2(g)CO(g)+H2O(g)��H2=+41kJmol-1
��ϸ�˹���ɣ���Ӧi+��Ӧii���ɵ÷�Ӧiii��
(4)����CO����������ȼ�ϵ�صĽ���Ĥ������
(5)������ѡ���Է����жϣ������¶ȵ�����һ����̼�����ʵ͡�
��(1)a���÷�Ӧ����������������䣬�������ܶ�Ϊ��ֵ����������ܶȲ��ٸı䲻��˵���ﵽƽ��״̬����a����
b���÷�Ӧ�����������䣬�������ʵ����ı䣬���������ƽ��Ħ������Ϊ�仯ֵ���������ƽ��Ħ���������ٸı����˵���ﵽƽ��״̬����b��ȷ��
c��H2��CO��CH3OH��Ũ��֮��Ϊ2:1:1����˵���ﵽƽ��״̬����c����
d����λʱ��������1molCO��ͬʱ����2molH2����˵���ﵽƽ��״̬����d��ȷ��
�ʴ�Ϊ��bd��
(2)���¶���ͬʱ��p1���߶�Ӧ��CH3OH����������ϸߣ���˵������ѹǿƽ�����ƣ���p1��p2�����B���¶ȸ���A���¶ȣ���v��(A)��v��(B)��
��C��ʱ��CH3OH���������Ϊ50%��

V(CH3OH)%=![]() ��100%=
��100%=![]() ��100%=50%�����x=0.75mol��ת������(H2)=
��100%=50%�����x=0.75mol��ת������(H2)= ![]() =
=![]() ��100%=75%��ƽ�ⳣ��KP=
��100%=75%��ƽ�ⳣ��KP=![]() �� p(H2)=
�� p(H2)=![]() ��p2��p(CO)=
��p2��p(CO)=![]() ��p2��p(CH3OH)=
��p2��p(CH3OH)=![]() ��p2 ��KP=
��p2 ��KP=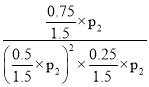 =
=![]() ��
��
��(3)��֪����Ӧi(��)��CH3OH(g)+H2O(g)CO2(g)+3H2(g)��H1=+49kJmol1
��Ӧii(��)��H2(g)+CO2(g)CO(g)+H2O(g)��H2=+41kJmol1
��ϸ�˹���ɣ���Ӧi+��Ӧii���ɵ÷�Ӧiii:CH3OH(g)CO(g)+2H2(g)��H3=(+49+41)kJ/mol=+90kJ/mol��
(4)����������ƽ�����ƣ����CH3OHת���ʣ���CO����������ȼ�ϵ�صĽ���Ĥ��
(5)������ѡ���Է����жϣ������¶ȵ�����һ����̼�����ʵͣ�˵�������Է�Ӧii��ѡ���Բ

 ����ͼ���������������ϵ�д�
����ͼ���������������ϵ�д�