题目内容
【题目】(NH4)2Cr2O7可用作有机合成催化剂、媒染剂 、显影液等。 某化学兴趣小组对(NH4)2Cr2O7 的部分性质及组成进行探究 。已知 :Cr2O72-(橙色)+H2O22 CrO42- (黄色)+2H+。 请回答下列问题
(1)向盛有少量(NH4)2Cr2O7 固体的试管中.滴加足量浓KOH溶液.振荡、微热 ,观察到的实验现象有_______________ 。
(2) 为探究(NH4)2Cr2O7 (摩尔质量为 252g/mol)的分解产物 .按下图连接好装置,在A中加入5.040 g 样品进行实验 。
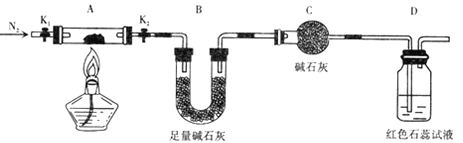
①仪器C的名称是____________ 。
②连接好装置后需进行的必要橾作是 ________,点燃酒精灯之前需进行的必要橾作是
___________________________。
③反应结束后.依然要通一段时间氮气的原因是 ____________________ .
④加热A至恒重,观察到D中溶液不变色,同时测得A中残留物为 Cr2O3 ,B中质量变化为1.44g. 写出( NH4)2Cr2O7加热分解的化学方程式:____________。
(3)实验室常用甲醛法测定含( NH4)2Cr2O7 的样品中氮的质量分数(杂质不发生反应),其反应原理为2Ba2++ Cr2O72-+H2O=2BaCrO4↓+2H+、4NH4++6HCHO=3H++6H2O +(CH2)6N4H+[ 滴定时 l mol(CH2)6N4H+ 与 l mol H+ 相当].然后用 NaOH标准溶液滴定 反应生成的酸。
实验步骤:称取品8.400g. 配成500mL溶液,移取25.00mL, 样品溶液于250mL锥形瓶中.用氯化钡溶液使Cr2O72- 完全沉淀后加入15.00mL2 0.00molL-1的中性甲醛溶液,摇 匀、静置5min 后,加入1- 2 滴酚酞试液 ,用0 .2000molL-1 NaOH标准溶液滴定至终点。重复上述操作 3次,最终滴定用去NaOH 标准溶液体积的平均值为 30.00mL。
①若滴定终点时,仰视读数。则测定结果 ____(填 “偏大”“偏小”或“无影响 ”)。
②样品中氮的质量分数为 _____________ 。
【答案】固体溶解,产生无色、有刺激性气味的气体,溶液由橙色变为黄色 (球形) 干燥管 检查装置的气密性 通入氮气一段时间将装置内空气排尽 将A中分解产生的气体全部赶入B中 ,防止产生实验误差 (NH4)2Cr2O7![]() Cr2O3+N2↑+4H2O 偏大 10.00%
Cr2O3+N2↑+4H2O 偏大 10.00%
【解析】
(1)根据加入碱对平衡Cr2O72-(橙色)+H2O2CrO42-(黄色)+2H+的影响,结合铵根离子的性质分析解答;
(2)①根据仪器C的结构分析判断;
②根据装置内存在空气分析解答;
③反应结束后,装置中仍残留少量生成的气体;
④加热A至恒重,观察到D中溶液不变色,说明无氨气生成,生成的是氮气,同时测得A中残留物为Cr2O3、B中质量的变化为1.44g,为吸收的水蒸气,结合定量关系计算写出化学方程式;
(3)根据沉淀重铬酸根离子生成氢离子2xmol,铵根离子和甲醛反应生成氢离子相当于4molNH4+反应生成4molH+,利用氢离子物质的量和氢氧根物质的量相同计算解答。
(1)在试管中加入少量(NH4)2Cr2O7固体,溶液中存在滴加足量浓KOH溶液,振荡、微热,铵根离子与碱反应放出氨气、氢离子浓度减小,溶液中的Cr2O72-(橙色)+H2O 2CrO42-(黄色)+2H+平衡正向进行,溶液显黄色,因此观察到的主要现象是:固体溶解;产生无色、有刺激性气味的气体;溶液由橙色变为黄色,故答案为:固体溶解;产生无色、有刺激性气味的气体,溶液由橙色变为黄色;
(2)①根据装置图,仪器C为球形干燥管,故答案为:球形干燥管;
②连接好装置,需进行的必要操作是检查装置的气密性,点燃酒精灯之前,需要通入一段时间氮气,将装置内空气排尽,故答案为:检查装置的气密性;通入氮气一段时间将装置内空气排尽;
③反应结束后,依然通一段时间的氮气,可以将A中分解产生的气体全部赶入B中,防止产生实验误差,故答案为:将A中分解产生的气体全部赶入B中,防止产生实验误差;
④(NH4)2Cr2O7(摩尔质量为252g/mol)的分解产物,在A中加入5.040g样品,物质的量=![]() =0.02mol,加热A至恒重,观察到D中溶液不变色,说明无氨气生成,生成的是氮气,同时测得A中残留物为Cr2O3,B中质量的变化为1.44g,为吸收的水蒸气物质的量=
=0.02mol,加热A至恒重,观察到D中溶液不变色,说明无氨气生成,生成的是氮气,同时测得A中残留物为Cr2O3,B中质量的变化为1.44g,为吸收的水蒸气物质的量=![]() =0.08mol,据此定量关系,反应的化学方程式为(NH4)2Cr2O7
=0.08mol,据此定量关系,反应的化学方程式为(NH4)2Cr2O7![]() Cr2O3+N2↑+4H2O,故答案为:(NH4)2Cr2O7
Cr2O3+N2↑+4H2O,故答案为:(NH4)2Cr2O7![]() Cr2O3+N2↑+4H2O;
Cr2O3+N2↑+4H2O;
(3)①若滴定终点时,仰视读数,读取消耗氢氧化钠溶液增大,则测定结果偏大,故答案为:偏大;
②反应原理为2Ba2++Cr2O72-+H2O=2BaCrO 4↓+2H+、4NH4++6HCHO=3H++6H2O+(CH2)6N4H+ [滴定时,1mo1(CH2)6N4H+与1mo1H+相当],然后用NaOH标准溶液滴定反应生成的酸,设25.00 mL样品溶液中含有(NH4)2Cr2O7的物质的量为x,则沉淀重铬酸根离子时生成氢离子2xmol,铵根和甲醛反应生成氢离子相当于4molNH4+反应生成4molH+,用0.200mo1L-1 NaOH标准溶液滴定至终点。重复上述操作3次,最终滴定用去NaOH标准溶液体积的平均值为30.00mL,2x+2x=0.030L×0.200mol/L,解得:x=0.0015mol,则原样品中含有(NH4)2Cr2O7的物质的量为0.0015mol×![]() =0.03mol,该样品中氮的质量分数=
=0.03mol,该样品中氮的质量分数=![]() ×100%=10.00%,故答案为:10.00%。
×100%=10.00%,故答案为:10.00%。