题目内容
11.元素R的气态氢化物为HxR.在标准状况下,8.5gHxR气体的体积是5.6L.HxR的式量34,若元素R的最高正化合价为+6价,则元素R的名称硫,x=2.
分析 根据n=$\frac{V}{{V}_{m}}$计算气体的物质的量,再根据M=$\frac{m}{n}$计算其摩尔质量,去式量在数值上等于其摩尔质量;
元素R的最高正化合价为+6价,则其最低负化合价为-2,故HxR中x为2,结合式量计算R的相对原子质量,进而确定元素.
解答 解:在标准状况下,8.5gHxR气体的体积是5.6L,其物质的量为$\frac{5.6L}{22.4L/mol}$=0.25mol,其摩尔质量为$\frac{8.5g}{0.25mol}$=34g/mol,故HxR的式量34;
元素R的最高正化合价为+6价,则其最低负化合价为-2,故HxR中x为2,R的相对原子质量为34-2-32,则R为硫元素,
故答案为:34;硫;2.
点评 本题考查原子结构与元素性质,比较基础,关键是理解最高正化合价与最低负化合价的关系.

练习册系列答案
相关题目
1.CCTV《科技博览》报道,2004年3月中科院首创用CO2合成可降解塑料聚二氧化碳.下列相关说法合理的是( )
| A. | 聚二氧化碳塑料是通过加聚反应制得的 | |
| B. | 聚二氧化碳塑料与干冰互为同素异形体 | |
| C. | 聚二氧化碳塑料与干冰都属于纯净物 | |
| D. | 聚二氧化碳塑料的使用会产生白色污染 |
2.下列有关说法正确的是( )
| A. | 常温下,0.1mol•L-1 Na2S溶液中存在:c(OH-)=c(H+ )+c(HS-)+c(H2S) | |
| B. | PH=3的醋酸溶液中:c(H+ )=c(CH3COO-)=0.3mol•L-1 | |
| C. | 某溶液中由水电离出的c(OH- )=1×10-a mol•L-1,若a>7时,则该溶液的pH可能为a | |
| D. | pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(NH4+ )>c(H+ )>c(OH- ) |
19.燃烧质量相同的下列各有机物时,消耗氧气的量最多的是( )
| A. | 乙醇 | B. | 丙醇 | C. | 乙二醇 | D. | 丙三醇 |
6.下列说法中,正确的是( )
| A. | 分子中键的极性越强,分子越稳定 | |
| B. | 分子中共价键的键能越大,该物质的性质越不活泼 | |
| C. | 分子中共价键的键能越大,键越长,则分子越稳定 | |
| D. | 若把H2S写成H3S,违背了共价键的饱和性 |
16.下列表示元素的基态原子的电子排布式,其中表示的元素属于第三周期的元素的是( )
| A. | 1s22s1 | B. | 1s22s22p5 | ||
| C. | 1s22s22p63s2 | D. | 1s22s22p63s23p64s1 |
3.下表是周期表中的一部分,根据A-I在周期表中的位置,第(1)~(4)小题用元素符号或化学式回答,(5)~(8)小题按题目要求回答.
(1)表中元素,化学性质最不活泼的是Ne,只有负价而无正价的是O、F.氧化性最强的单质是F2,还原性最强的单质是Na.
(2)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4,呈两性的是Al(OH)3.
(3)A分别与D、E、F、H、I形成的化合物中,最稳定的HF,
(4)在B、C、E、F、H、I中,原子半径最大的是Na,
(5)D和G组成化合物的电子式 ,
,
(6)A和E组成化合物可否用浓硫酸干燥不能;原因是:2NH3+H2SO4=(NH4)2SO4(用化学方程式回答)
(7)B与G形成1:1型化合物中含有的化学键类型离子键、共价键,
(8)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | H | J | |||
| 3 | B | C | F | I |
(2)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4,呈两性的是Al(OH)3.
(3)A分别与D、E、F、H、I形成的化合物中,最稳定的HF,
(4)在B、C、E、F、H、I中,原子半径最大的是Na,
(5)D和G组成化合物的电子式
 ,
,(6)A和E组成化合物可否用浓硫酸干燥不能;原因是:2NH3+H2SO4=(NH4)2SO4(用化学方程式回答)
(7)B与G形成1:1型化合物中含有的化学键类型离子键、共价键,
(8)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
20.标准状况下,某同学向100mL H2S饱和溶液中通入SO2,所得溶液pH变化如图所示.下列分析中正确的是( )
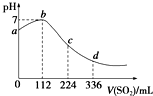

| A. | b点对应的溶液导电性最强 | |
| B. | 亚硫酸是比氢硫酸更弱的酸 | |
| C. | ab段反应是SO2+2H2S═3S↓+2H2O | |
| D. | 原H2S溶液的物质的量浓度为0.05mol•L-1 |