题目内容
14.镁在空气里点燃可以燃烧,放出大量的热并发出耀眼的白光,生成白色的氧化镁,同时,镁在这样的高温条件下,还可与空气中的另一种主要成分反应,生成少量的物质A,已知A可发生如下的一系列变化: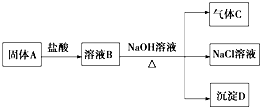
(1)写出A、C、D的化学式:AMg3N2、CNH3、DMg(OH)2.
(2)写出下列变化的化学方程式:
①固体A+盐酸Mg3N2+8HCl=3MgCl2+2NH4Cl②溶液B+NaOH溶液MgCl2+2NaOH=2NaCl+Mg(OH)2↓,2NH4Cl+2NaOH$\frac{\underline{\;\;△\;\;}}{\;}$2NaCl+2NH3↑+2H2O.
分析 金属镁可以和空气中的氧气发生反应,生成氧化镁,还可以和空气中的氮气发生反应生成氮化镁,氮化镁可以和盐酸之间发生反应氯化镁和氯化铵,氯化铵和氢氧化钠之间发生反应得到氨气、氯化钠和水,氯化镁和氢氧化钠之间反应得到氢氧化镁沉淀,据方程式的书写方法回答即可.
解答 解:金属镁可以和空气中的氧气发生反应,生成氧化镁,还可以和空气中的氮气发生反应生成氮化镁,氮化镁可以和盐酸之间发生反应氯化镁和氯化铵,氯化铵和氢氧化钠之间发生反应得到氨气、氯化钠和水,氯化镁和氢氧化钠之间反应得到氢氧化镁沉淀,
(1)金属镁可以和空气中的氧气发生反应,生成氧化镁,还可以和空气中的氮气发生反应生成氮化镁,根据溶液B可以和氢氧化钠加热产生气体,可以推知是氨气,所以A是氮化镁,化学式为:Mg3N2,氯化铵和氢氧化钠之间发生反应得到氨气、氯化钠和水,氯化镁和氢氧化钠之间反应得到氢氧化镁沉淀,C是NH3,D是Mg(OH)2,故答案为:Mg3N2;NH3;Mg(OH)2;
(2)①固体A(氮化镁)和盐酸的反应为:Mg3N2+8HCl=3MgCl2+2NH4Cl,故答案为:Mg3N2+8HCl=3MgCl2+2NH4Cl;
②溶液B中含有氯化镁和氯化铵,和NaOH溶液加热下发生的反应为:MgCl2+2NaOH=2NaCl+Mg(OH)2↓,2NH4Cl+2NaOH$\frac{\underline{\;\;△\;\;}}{\;}$2NaCl+2NH3↑+2H2O,
故答案为:MgCl2+2NaOH=2NaCl+Mg(OH)2↓,2NH4Cl+2NaOH$\frac{\underline{\;\;△\;\;}}{\;}$2NaCl+2NH3↑+2H2O.
点评 本题考查学生金属镁、铵盐的化学性质以及化学方程式的书写知识,注意知识的归纳和梳理是关键,难度中等.

| A. | 分离、提纯→确定分子式→确定实验式→确定结构式 | |
| B. | 分离、提纯→确定实验式→确定分子式→确定结构式 | |
| C. | 分离、提纯→确定结构式→确定实验式→确定分子式 | |
| D. | 确定分子式→确定实验式→确定结构式→分离、提纯 |

已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5.根据以上流程图,下列说法不正确的是( )
| A. | 操作II中,通入硫化氢至饱和的目的是使Sn2+转化为SnS沉淀并防止Fe2+被氧化 | |
| B. | 在溶液中用硫酸酸化至pH=2的目的防止Fe2+沉淀 | |
| C. | 操作Ⅰ所得滤液中可能含有Fe3+ | |
| D. | 常用标准KMnO4溶液滴定的方法测定绿矾产品中Fe2+的含量,滴定时发生反应的离子方程式为:5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O |
| A. | Q1=Q2 | B. | Q1>Q2 | C. | Q1<Q2 | D. | 无法判断 |
(1)已知:①CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41kJ•mol-1
②C(s)+2H2(g)?CH4(g)△H=-73kJ•mol-1
③2CO(g)?C(s)+CO2(g)△H=-171kJ•mol-1
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H=-162 kJ•mol-1.
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g)
已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2)/n(CO2)]的变化曲线如图1:

①在其他条件不变时,请在图2中画出平衡时CH3OCH3的体积分数随投料比[n(H2)/n(CO2)]变化的曲线图.
②某温度下,将2.0mol CO2(g)和6.0mol H2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图3示,关于温度和压强的关系判断正确的是BD.
A.P3>P2,T3>T2 B.P1>P3,T1>T3 C.P2>P4,T4>T2 D.P1>P4,T2>T3
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的CO和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
| A. | 硅胶作干燥剂是利用其多孔、吸附水分的能力强 | |
| B. | 铝在空气中必须出良好的抗腐蚀性,说明铝极难与氧气反应 | |
| C. | 明矾可用于饮水的消毒杀菌 | |
| D. | 光导纤维比普通电缆有更强的传输信息能力,是因为其导电能力强 |

