题目内容
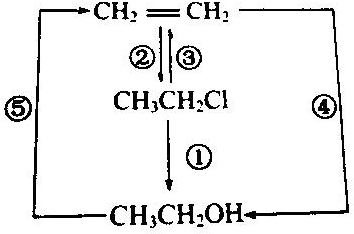
11.某课外活动小组为探究金属与浓硫酸反应,进行了如下实验.Ⅰ.探究浓硫酸与铜反应时硫元素与氢元素的氧化性强弱:
实验装置如图1所示.(固定装置已略去)
(1)A中反应的化学方程式为2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+SO42-+Cu2++2H2O.
(2)F烧杯中的溶液通常是NaOH溶液(或酸性KMnO4溶液等).
(3)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是D装置中黑色固体颜色无变化,E中溶液褪色.
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是将A装置中试管内冷却的混合物沿杯壁(或玻璃棒)缓缓倒入盛有水的烧杯中,并不断搅拌,看溶液是否变蓝.
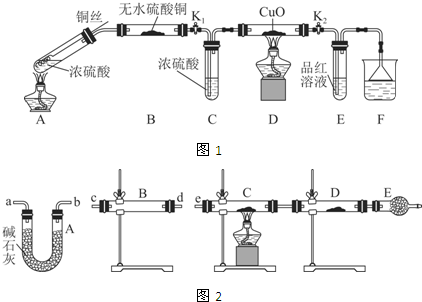
Ⅱ.研究过量的锌与浓硫酸反应产生的气体:
(1)过量的锌与浓硫酸反应制取的二氧化硫气体中可能含有的杂质是氢气和水蒸气;
(2)某同学用下列装置(如图2)连接成一整套实验装置以验证(2)的判断是否正确,若按气体从左到右流向时,气体流经的各装置导管的编号依次是cd(或dc)ab(或ba)e(用a、b…填写).
(3)根据(3)确定的实验过程,请将实验时有关装置中所盛药品、实验现象、结论或解释填入下列横线上:
| 装置 | 所盛药品 | 实验现象 | 结论或解释 |
| B | ① | ② | ③ |
| C | CuO固体 | ④ | ⑤ |
分析 Ⅰ.(1)铜与浓硫酸加热反应生成硫酸铜、二氧化硫气体和水,据此写出反应的化学方程式;
(2)二氧化硫有毒,多余的二氧化硫气体需要用氢氧化钠溶液或酸性高锰酸钾溶液吸收;
(3)根据C中氧化铜是否被还原及E中品红溶液是否褪色判断;
(4)反应后的混合液中含有浓硫酸,不能向冷却后的溶液中加水,否则会导致液体溅出,应该类比稀释浓硫酸的方法进行操作;
Ⅱ.(1)随着反应的进行浓硫酸被消耗会变成稀硫酸,锌与稀硫酸反应产生氢气,所以SO2中的杂质可能为H2和H2O(g);
(2)检验H2的方法常用灼热的CuO反应生成水,检验水的存在,这里有水蒸气的存在,注意操作的顺序,先检验水的存在,将水除尽,再检验H2和CuO反应生成的水;
(3)实验先检验是否含有水,利用无水硫酸铜吸水变蓝色检验;将水除尽,再检验H2和CuO反应生成的水.
解答 解:Ⅰ.(1)碳和浓硫酸在加热条件下生成二氧化碳、二氧化硫和水,反应的化学方程式为:2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+SO42-+Cu2++2H2O,
故答案为:2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+SO42-+Cu2++2H2O;
(2)二氧化硫气体是一种有毒气体,剩余的二氧化硫气体不能直接排放,应该用NaOH溶液或酸性KMnO4溶液等吸收,
故答案为:NaOH溶液(或酸性KMnO4溶液等);
(3)由于D装置中黑色固体颜色无变化,E中溶液褪色,说明反应生成了二氧化硫,证明反应中S元素被还原,在反应中作氧化剂,而氢离子没有被还原,所以浓硫酸的中S的氧化性大于氢离子,
故答案为:D装置中黑色固体颜色无变化,E中溶液褪色;
(4)含有铜离子的溶液显示蓝色,需要将反应后的溶液用水稀释,由于反应后的溶液中含有浓硫酸,所以应该将A装置中试管内冷却的混合物沿杯壁(或玻璃棒)缓缓倒入盛有水的烧杯中,并不断搅拌,看溶液是否变蓝,
故答案为:将A装置中试管内冷却的混合物沿杯壁(或玻璃棒)缓缓倒入盛有水的烧杯中,并不断搅拌,看溶液是否变蓝;
Ⅱ.(1)随着反应的进行浓硫酸被消耗会变成稀硫酸,锌与稀硫酸反应产生氢气,所以SO2中的杂质可能为H2和H2O(g),
故答案为:氢气和水蒸气;
(3)先检验水的存在,将水除尽,再检验H2和CuO反应生成的水,B装置检验水,A装置除去气体中的水蒸气,C、D用于检验气体中是否含有H2,所以气流方向为:c d(或d c)a b(或b a)e,
故答案为:c d(或d c)a b(或b a)e;
(4)B装置检验水,装置内盛放无水硫酸铜,若固体由白色变成蓝色,说明SO2中含有水蒸气;
若含有H2,在装置C中发生反应H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O,固体由黑色变成红色,D装置内固体由白色变成蓝色,说明SO2中含有氢气,
故答案为:
| 装置 | 所盛药品 | 实验现象 | 结论或解释 |
| B | 无水硫酸铜 | 固体由白色变成蓝色 | SO2中含有水蒸气 |
| C | C装置中固体由黑色变成红色,D装置内固体由白色变成蓝色 | SO2中含有氢气 |
点评 本题考查了浓硫酸的性质、常见气体检验的方法和操作顺序、对实验原理的理解等,题目难度中等,注意掌握浓硫酸的性质及常见气体的检验方法,Ⅱ(3)中要检验SO2中是否含有H2和H2O(g),需要注意检验的顺序,应该先检验水,然后除去二氧化硫后再检验氢气.

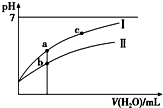 已知:25℃时某些弱酸的电离平衡常数(如表).下面图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )
已知:25℃时某些弱酸的电离平衡常数(如表).下面图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( ) | CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
| A. | 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O═2HClO+CO32- | |
| C. | 图象中a、c两点处的溶液中$\frac{c({R}^{-})}{c(HR)•c(O{H}^{-})}$相等(HR代表CH3COOH或HClO) | |
| D. | 图象中a点酸的总浓度大于b点酸的总浓度 |

已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5.根据以上流程图,下列说法不正确的是( )
| A. | 操作II中,通入硫化氢至饱和的目的是使Sn2+转化为SnS沉淀并防止Fe2+被氧化 | |
| B. | 在溶液中用硫酸酸化至pH=2的目的防止Fe2+沉淀 | |
| C. | 操作Ⅰ所得滤液中可能含有Fe3+ | |
| D. | 常用标准KMnO4溶液滴定的方法测定绿矾产品中Fe2+的含量,滴定时发生反应的离子方程式为:5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O |
(1)已知:①CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41kJ•mol-1
②C(s)+2H2(g)?CH4(g)△H=-73kJ•mol-1
③2CO(g)?C(s)+CO2(g)△H=-171kJ•mol-1
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H=-162 kJ•mol-1.
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g)
已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2)/n(CO2)]的变化曲线如图1:

①在其他条件不变时,请在图2中画出平衡时CH3OCH3的体积分数随投料比[n(H2)/n(CO2)]变化的曲线图.
②某温度下,将2.0mol CO2(g)和6.0mol H2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图3示,关于温度和压强的关系判断正确的是BD.
A.P3>P2,T3>T2 B.P1>P3,T1>T3 C.P2>P4,T4>T2 D.P1>P4,T2>T3
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的CO和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 无色溶液中滴加氯水和CCl4,振荡、静置 | 上层溶液显紫色 | 原溶液中有I- |
| B | 将SO2通入酸性KMnO4溶液中 | 紫色褪去 | SO2具有还原性 |
| C | 向明矾溶液中通入过量氨气 | 先产生大量白色沉淀,后沉淀逐渐消失 | Al(OH)3能溶于氨水 |
| D | AgI沉淀中滴入浓KCl溶液 | 有白色沉淀出现 | 溶解度:AgCl<AgI |
| A. | A | B. | B | C. | C | D. | D |

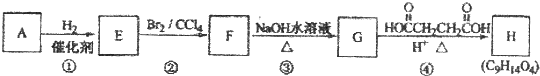
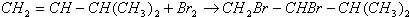 ;
;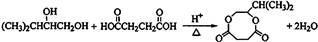 .
.