题目内容
15.分子式为CxHyO2的有机物1mol在氧气中燃烧,产生二氧化碳和水蒸气的体积相等,并耗氧气3.5mol,则该有机物中x、y的值分别为( )| A. | 1、2 | B. | 2、3 | C. | 3、6 | D. | 4、6 |
分析 有机物完全燃烧,生成二氧化碳与水蒸气的体积相等(同温同压),即生成二氧化碳和水的物质的量是相等的,碳原子和氢原子的个数之比是1:2,1molCxHyO2的耗氧量为x+$\frac{y}{4}$-1,据此计算x和y的值.
解答 解:分子式为CxHyO2的有机化合物1mol在氧气中完全燃烧后,生成二氧化碳与水蒸气的体积相等(同温同压),即生成二氧化碳和水的物质的量是相等的,碳原子和氢原子的个数之比是1:2,1molCxHyO2的耗氧量为x+$\frac{y}{4}$-1=3.5,所以x+$\frac{y}{4}$=4.5成立即可.
A、x=1,y=2,不符合等式x+$\frac{y}{4}$=4.5,故A错误;
B、x=2,y=3不符合碳原子和氢原子的个数之比是1:2,故B错误;
C、x=3,y=6符合碳原子和氢原子的个数之比是1:2,符合等式x+$\frac{y}{4}$=4.5,故C正确;
D、x=4,y=6不符合碳原子和氢原子的个数之比是1:2,故D错误.
故选C.
点评 本题主要考查了学生对有机物燃烧耗氧量的计算知识的理解,注意原子守恒思想和耗氧量规律的灵活应用是关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.天然提取和人工合成的有机物往往是混合物,假设给你一份有机混合物让你进行研究,一般要采取的几个步骤是( )
| A. | 分离、提纯→确定分子式→确定实验式→确定结构式 | |
| B. | 分离、提纯→确定实验式→确定分子式→确定结构式 | |
| C. | 分离、提纯→确定结构式→确定实验式→确定分子式 | |
| D. | 确定分子式→确定实验式→确定结构式→分离、提纯 |
10.某溶液中可能含有Na+、K+、AlO2-、CO32-、SO32-、Cl-中的若干种离子.某同学设并完成了如下实验:
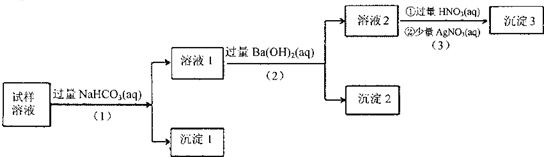
已知:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
根据以上的实验操作与现象,该同学得出的结论不正确的是( )

已知:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
根据以上的实验操作与现象,该同学得出的结论不正确的是( )
| A. | 沉淀2放置在空气中,若质量增加,试样中肯定存在SO32- | |
| B. | 试样溶液中加人稍过量的NH4C1溶液能得到与沉淀1成分相同的物质 | |
| C. | 上述流程步骤(1)(2)(3)的顺序改为(3)(2)(1),可能会获得相同的实验现象 | |
| D. | 试样溶液中肯定存在A102-、Cl-,其中Na+、K+至少存在1种 |
20.下列有关的实验操作、现象和解释或结论都正确的是( )
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 无色溶液中滴加氯水和CCl4,振荡、静置 | 上层溶液显紫色 | 原溶液中有I- |
| B | 将SO2通入酸性KMnO4溶液中 | 紫色褪去 | SO2具有还原性 |
| C | 向明矾溶液中通入过量氨气 | 先产生大量白色沉淀,后沉淀逐渐消失 | Al(OH)3能溶于氨水 |
| D | AgI沉淀中滴入浓KCl溶液 | 有白色沉淀出现 | 溶解度:AgCl<AgI |
| A. | A | B. | B | C. | C | D. | D |
7.25℃时,部分弱酸的电离平衡常数如表所示.下列反应的离子方程式书写错误的是( )
| 弱酸 | H2SO3 | HClO | H2CO3 |
| Ka1 | 1.54×10-2 | 2.95×10-8 | 4.30×10-7 |
| Ka2 | 1.02×10-7 | - | 5.61×10-11 |
| A. | NaClO溶液中通入少量CO2:ClO-+H2O+CO2═HCO3-+HClO | |
| B. | 氯水中加入少量NaCO3粉末:HCO3-+H+═H2O+CO2↑ | |
| C. | NaClO溶液中通入少量SO2:2ClO-+H2O+SO2═SO32-+2HClO | |
| D. | Na2CO2溶液中缓慢通入少量SO2:2CO32-+H2O+SO2═SO32-+2HCO3- |
4.下列说法或解释正确的是( )
| A. | 硅胶作干燥剂是利用其多孔、吸附水分的能力强 | |
| B. | 铝在空气中必须出良好的抗腐蚀性,说明铝极难与氧气反应 | |
| C. | 明矾可用于饮水的消毒杀菌 | |
| D. | 光导纤维比普通电缆有更强的传输信息能力,是因为其导电能力强 |
5.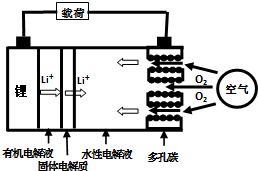 金属锂燃料电池是一种新型电池,比锂离子电池具有更高的能量密度.它无电时也无需充电,只需更换其中的某些材料即可,其工作示意图如下,下列说法正确的是( )
金属锂燃料电池是一种新型电池,比锂离子电池具有更高的能量密度.它无电时也无需充电,只需更换其中的某些材料即可,其工作示意图如下,下列说法正确的是( )
 金属锂燃料电池是一种新型电池,比锂离子电池具有更高的能量密度.它无电时也无需充电,只需更换其中的某些材料即可,其工作示意图如下,下列说法正确的是( )
金属锂燃料电池是一种新型电池,比锂离子电池具有更高的能量密度.它无电时也无需充电,只需更换其中的某些材料即可,其工作示意图如下,下列说法正确的是( )| A. | 放电时,空气极为负极 | |
| B. | 放电时,电池反应为:4Li+O2=2Li2O | |
| C. | 有机电解液可以是乙醇等无水有机物 | |
| D. | 在更换锂电极的同时,要更换水性电解液 |

