题目内容
6.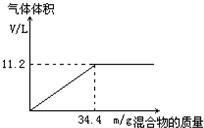 在100mL NaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热充分反应.如图表示加入的混合物的质量与产生的气体体积(标准状况)的关系.
在100mL NaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热充分反应.如图表示加入的混合物的质量与产生的气体体积(标准状况)的关系.(1)NaOH溶液的物质的量浓度为5mol/L.
(2)当NaOH溶液的体积为80mL,固体混合物的质量为34.4g,充分反应后,生成气体的体积在标准状况下为8.96升.
(3)当NaOH溶液的体积为120mL,固体混合物的质量仍为34.4g,充分反应后,生成气体的体积在标准状况下为11.2升.
分析 (1)氢氧化钠与NH4NO3和(NH4)2SO4的混合物生成氨气,发生反应NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O,由图象可知,加入固体34.4g时生成氨气体积增大为11.2L,根据n=$\frac{V}{{V}_{m}}$氨气的物质的量,结合方程式计算氢氧根的物质的量,再根据c=$\frac{n}{V}$计算氢氧化钠的物质的量浓度;
(2)当固体混合物的质量是34.4g时,完全反应需要消耗100mL氢氧化钠溶液,当NaOH溶液的体积为80mL时,明固体过量,故n(NH3)=n(NaOH),根据n=cV计算出氢氧化钠的物质的量,再根据V=nVm计算出氨气的体积;
(3)由(2)分析可知,当V(NaOH)=120mL时,说明NaOH过量,则固体完全反应,生成的氨气的体积为11.2L.
解答 解:(1)氢氧化钠与NH4NO3和(NH4)2SO4的混合物生成氨气,发生反应NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O,从图中可看出34.4 g混合物和100 mL NaOH恰好完全反应.则n(NaOH)=n(NH3)=$\frac{11.2L}{22.4L/mol}$=0.5 mol,
c(NaOH)=$\frac{0.5mol}{0.1L}$=5mol/L,
故答案为:5mol/L;
(2)当固体混合物的质量34.4g时,固体混合物完全反应消耗的氢氧化钠溶液的体积为100mL,则氢氧化钠溶液不足,固体有剩余,则n(NH3)=n(NaOH)=5 mol/L×0.08L=0.4mol,V(NH3)=0.4mol×22.4 L/mol=8.96 L,
故答案为:8.96;
(3)由(2)分析可知,当V(NaOH)=120 mL时,说明NaOH过量,固体34.4g完全反应,故生成氨气的体积为:V(NH3)=11.2L,
故答案为:11.2.
点评 本题以图象形式考查混合物的有关计算,题目难度中等,明确发生反应的实质为解答关键,试题综合考查学生分析解决问题的能力及化学计算能力.

 小题狂做系列答案
小题狂做系列答案| A. | 空气是混合物--空气由不同种分子构成 | |
| B. | 热胀冷缩--分子的间隔随温度的改变而改变 | |
| C. | 电解水生成氢气和氧气--说明水中含有氢分子和氧分子 | |
| D. | 有同学在教室吃榴莲糖,整个教室都可以闻到榴莲味--分子在不断地运动 |
| A. | 移液后未洗涤烧杯 | |
| B. | 在容量瓶中进行定容时,仰视刻度线 | |
| C. | 在容量瓶中进行定容时,俯视刻度线 | |
| D. | 定容后摇匀,发现液面低于刻度线,再加水至刻度线 |
| A. | 青蒿素 | B. | 青霉素 | C. | 虾青素 | D. | 维生素 |

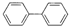 分子式:C12H10
分子式:C12H10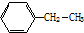 其苯环上的一氯代物有_5种
其苯环上的一氯代物有_5种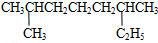 的系统命名是2,6-二甲基辛烷
的系统命名是2,6-二甲基辛烷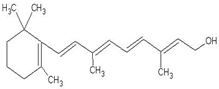 1mol该物质消耗5molH2,5molBr21molNa
1mol该物质消耗5molH2,5molBr21molNa 开发新能源,使用清洁燃料,可以达到减少污染的目的.
开发新能源,使用清洁燃料,可以达到减少污染的目的.