题目内容
1.实验室配制1000mL0.100mol/LNa2CO3溶液,现有下列仪器:天平、药匙、量筒、烧杯、玻璃棒,(1)配制时,还缺少的玻璃仪器有1000mL容量瓶、胶头滴管.
(2)用托盘天平称取Na2CO3•10H2O晶体的质量为28.6g
(3)若实验中遇下列情况,所配制的溶液的浓度偏高的是AF
A.溶解后没有冷却便进行定容
B.定容时仰视容量瓶的刻度线
C.摇匀后发现液面低于刻度线,滴加蒸馏水至刻度线再摇匀
D.容量瓶内壁附有水珠而未干燥处理
F.称取的Na2CO3•10H2O晶体失去了部分结晶水
(4)若取50.0mL上述已配好的溶液,与另一150mL0.300mol/L的Na2CO3溶液混合,最后得到的溶液的物质的量浓度为0.25 mol/L(设溶液的体积变化可忽略).
分析 (1)依据配制一定物质的量浓度溶液的一般步骤选择仪器;
(2)依据m=CVM计算需要溶质的物质的量;
(3)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
(4)计算溶液混合后所含有溶质的物质的量和溶液的体积,依据C=$\frac{n}{V}$计算其浓度.
解答 解:(1)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、移液、洗涤、定容等,用到的仪器:托盘天平、药匙、烧杯、玻璃棒、1000mL
容量瓶、胶头滴管;所以还缺少的玻璃仪器有:1000mL容量瓶、胶头滴管;
故答案为:1000mL容量瓶、胶头滴管;
(2)配制1000mL0.100mol/LNa2CO3溶液,需要Na2CO3•10H2O晶体的质量m=0.100mol/L×286g/mol×1L=28.6g,故答案为:28.6;
(3)A.溶解后没有冷却便进行定容,冷却后溶液体积偏小,溶液浓度偏高,故A选;
B.定容时仰视容量瓶的刻度线,导致溶液体积偏大,溶液浓度偏低,故B不选;
C.摇匀后发现液面低于刻度线,滴加蒸馏水至刻度线再摇匀,导致溶液体积偏大,溶液浓度偏低,故C不选;
D.容量瓶内壁附有水珠而未干燥处理,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度不变,故D不选;
F.称取的Na2CO3•10H2O晶体失去了部分结晶水,导致称取的溶质的物质的量偏大,溶液浓度偏高,故E选;
故选:AF;
(4)若取50.0mL上述已配好的溶液,与另一150mL0.300mol/L的Na2CO3溶液混合,最后得到的溶液的物质的量浓度为$\frac{0.1×50+0.3×150}{200}$=0.25mol/L,
故答案为:0.25 mol/L.
点评 本题考查了一定物质的量浓度溶液的配制、溶液的稀释与混合等,明确配制原理是解题关键,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 氧气 | B. | 氮气 | C. | 二氧化碳 | D. | 稀有气体 |
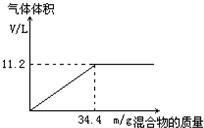 在100mL NaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热充分反应.如图表示加入的混合物的质量与产生的气体体积(标准状况)的关系.
在100mL NaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热充分反应.如图表示加入的混合物的质量与产生的气体体积(标准状况)的关系.