题目内容
15.25℃时,氨水中存在NH3•H2O?NH${\;}_{4}^{+}$+OH-,据平衡常数表达式推理,NH3•H2O中存在$\frac{c(N{H}_{4}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=1.75×10-5,其中1.75×10-5是该温度下的电离平衡常数,该常数不随浓度改变,只随温度变化.计算:(1)0.1mol/L的氨水中c(OH-)是多少?
(2)若氨水中c(OH-)=0.01mol/L,求c(NH3•H2O).
分析 (1)25℃时,0.1mol/L氨水溶液中存在NH3.H2O?NH4++OH-,水的电离程度很小,所以溶液中水电离出的C(OH-)可以忽略不计,则C(OH-)=$\sqrt{K.C(N{H}_{3}.{H}_{2}O)}$,溶液中C(H+)=$\frac{Kw}{c(O{H}^{-})}$,pH=-lgc(H+);
(2)根据c(NH3•H2O)=$\frac{{c}^{2}(O{H}^{-})}{{K}_{b}}$计算.
解答 解:(1)25℃时,0.1mol/L氨水溶液中存在NH3.H2O?NH4++OH-,水的电离程度很小,所以溶液中水电离出的C(OH-)可以忽略不计,则c(OH-)=$\sqrt{K.C(N{H}_{3}.{H}_{2}O)}$=$\sqrt{1.75×1{0}^{-5}×0.1}$mol/L=1.3×10-3 mol.L -1,
答:0.1mol/L的氨水中c(OH-)是1.3×10-3 mol.L -1;
(2)c(NH3•H2O)=$\frac{{c}^{2}(O{H}^{-})}{{K}_{b}}$=$\frac{(0.01mol/L)^{2}}{1.75×1{0}^{-5}}$=5.7mol/L;
答:c(NH3•H2O)为5.7mol/L.
点评 本题考查pH的简单计算、电离常数在计算中的应用,侧重考查分析计算能力,明确弱酸、弱碱中氢离子浓度或氢氧根离子浓度的计算方法是解本题关键,题目难度不大.

练习册系列答案
相关题目
5.下列有关实验操作叙述正确的是( )
| A. | NaOH固体置于大小相同的滤纸上称量 | |
| B. | 蒸馏操作时,冷凝水的方向须与气体的流向相同 | |
| C. | 配制稀硫酸时,将浓硫酸溶解后直接转移入容量瓶 | |
| D. | 分液时,先要打开分液漏斗上口活塞,再打开旋塞 |
3.有X、Y、Z、R四种短周期主族元素,Y、Z、R同周期.相关信息如下:
I.(1)Z元素在周期表的位置是第三周期第ⅦA族,Y、Z、R简单离子的半径从大到小的顺序是S2->Cl->Na+(用离子符号表示);
(2)由X、Z两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构.甲遇水可形成一种常见的漂白性物质.则甲的结构式为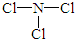 ;
;
(3)化合物乙(Y2R)溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Y2R2,其溶液显黄色.则Y2R2的电子式为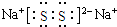 ,写出乙溶液在空气中变质生成Y2R2的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2.
,写出乙溶液在空气中变质生成Y2R2的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2.
II.元素X与氢可形成多种化合物,如丙、丁、戊.
(4)丙为一元弱酸,酸性与醋酸类似,对热十分稳定但受撞击就爆炸.8.6g丙爆炸分解生成H2和6.72L(标况下)X2.写出其爆炸的化学方程式2HN3=3N2+H2 ;
(5)丁为离子化合物,遇水反应生成H2和气体戊,标况下戊的密度为0.76g•L-1,则物质丁的化学式为NH4H;
(6)戊在高温条件下能还原Fe2O3,生成两种单质,写出该反应的化学方程式2NH3+Fe2O3$\frac{\underline{\;高温\;}}{\;}$N2+2Fe+3H2O,有人提出生成的产物中可能还有FeO,请设计实验方案验证(用化学方法)取固体生成物a g与足量盐酸反应,测定生成气体标况的体积为V L,若V<$\frac{a}{56}$,则含FeO,反之则无;或者取一定质量固体生成物与足量H2(或CO)共热充分反应,若质量减少则含FeO,反之则无.
| 相关信息 | |
| X | 单质为双原子分子.若低温蒸发液态空气,因其沸点较低可先获得X的单质 |
| Y | 含Y元素的物质焰色反应为黄色 |
| Z | 同周期元素中原子半径最小 |
| R | R元素原子的最外层电子数是K层电子数的3倍 |
(2)由X、Z两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构.甲遇水可形成一种常见的漂白性物质.则甲的结构式为
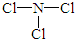 ;
;(3)化合物乙(Y2R)溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Y2R2,其溶液显黄色.则Y2R2的电子式为
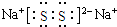 ,写出乙溶液在空气中变质生成Y2R2的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2.
,写出乙溶液在空气中变质生成Y2R2的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2.II.元素X与氢可形成多种化合物,如丙、丁、戊.
(4)丙为一元弱酸,酸性与醋酸类似,对热十分稳定但受撞击就爆炸.8.6g丙爆炸分解生成H2和6.72L(标况下)X2.写出其爆炸的化学方程式2HN3=3N2+H2 ;
(5)丁为离子化合物,遇水反应生成H2和气体戊,标况下戊的密度为0.76g•L-1,则物质丁的化学式为NH4H;
(6)戊在高温条件下能还原Fe2O3,生成两种单质,写出该反应的化学方程式2NH3+Fe2O3$\frac{\underline{\;高温\;}}{\;}$N2+2Fe+3H2O,有人提出生成的产物中可能还有FeO,请设计实验方案验证(用化学方法)取固体生成物a g与足量盐酸反应,测定生成气体标况的体积为V L,若V<$\frac{a}{56}$,则含FeO,反之则无;或者取一定质量固体生成物与足量H2(或CO)共热充分反应,若质量减少则含FeO,反之则无.
20.为了使Na2S溶液中$\frac{c(N{a}^{+})}{{c(S}^{2-})}$的比值变小,可采取的措施是( )
①加适量盐酸②加适量NaOH(s)③加适量KOH(s)
④加适量KHS(s)⑤加水⑥通H2S(g)⑦加热.
①加适量盐酸②加适量NaOH(s)③加适量KOH(s)
④加适量KHS(s)⑤加水⑥通H2S(g)⑦加热.
| A. | ②③④ | B. | ①②⑤⑥⑦ | C. | ②③ | D. | ③④ |
20.相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)?2NH3(g)△H=-92.6kJ/moL.实验测得起始、平衡时得有关数据如下表:
下列叙述错误的是( )
| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体系 能量的变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量:23.15kJ |
| ② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
| A. | 容器②中达平衡时放出的热量Q=23.15 kJ | |
| B. | 平衡时,两个容器中NH3的体积分数均为$\frac{1}{7}$ | |
| C. | 容器①、②中反应的平衡常数相等 | |
| D. | 若容器①体积为0.5L,则平衡时放出的热量<23.15kJ |
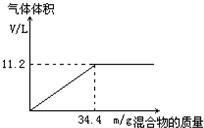 在100mL NaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热充分反应.如图表示加入的混合物的质量与产生的气体体积(标准状况)的关系.
在100mL NaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热充分反应.如图表示加入的混合物的质量与产生的气体体积(标准状况)的关系.