题目内容
【题目】富镍三元层状氧化物LiNi0.8Co0.1Mn0.1O2(NCM811)作为下一代锂离子电池的正极材被广泛关注和深入研究,纳米级TiO2形成的表面包覆对提高该材料的性能效果明显。回答下列问题:
(1)Li在元素周期表中的位置为___;基态Ni的电子排布式为___,基态Co3+有__个未成对电子。
(2)制备NCM811的过程中,残余的Li2CO3会破坏材料的界面,CO32-的空间构型是___,其中C原子的杂化方式为___。
(3)该电池初始充电过程中,会有C2H4等气体产生。C2H4分子中。![]() 键和
键和![]() 键数目之比为__。
键数目之比为__。
(4)TiO2的晶胞(![]() =
=![]() =
=![]() =90o)如图所示:
=90o)如图所示:
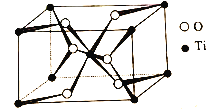
TiO2晶体中O原子的配位数是__,其晶胞参数为:a=b=459pm,c=295pm,该晶体的密度为__g/cm3(列出计算式)。
【答案】第二周期第ⅠA族 [Ar]3d84s2 4 平面三角形 sp2 5:1 3 ![]()
【解析】
(1)Li是3号元素,核外2个电子层、最外层有1个电子; Ni原子核外有28个电子,根据能量最低原理书写基态Ni原子电子排布式;电子在能量相同的轨道排布时,尽可能分占不同轨道。
(2)根据价电子互斥理论判断;
(3)单键为![]() 键,双键中有1个
键,双键中有1个![]() 键、1个
键、1个![]() 键。
键。
(3)根据晶胞图,与每个O原子离的最近的Ti原子有3个;根据均摊原则计算1个晶胞中的原子数,根据![]() 计算密度。
计算密度。
(1)Li是3号元素,核外2个电子层、最外层有1个电子,Li在元素周期表中的位置为第二周期第ⅠA族; Ni原子核外有28个电子,根据能量最低原理,Ni原子核外电子排布式为![]() 3d84s2;基态Co3+的价电子排布式为3d6, 电子在能量相同的轨道排布时,尽可能分占不同轨道,所以有4个未成对电子。
3d84s2;基态Co3+的价电子排布式为3d6, 电子在能量相同的轨道排布时,尽可能分占不同轨道,所以有4个未成对电子。
(2)CO32-中C原子的价电子对数是![]() ,C原子的杂化方式为sp2,C原子没有孤电子对,空间构型是平面三角形;
,C原子的杂化方式为sp2,C原子没有孤电子对,空间构型是平面三角形;
(3)单键为![]() 键,双键中有1个
键,双键中有1个![]() 键、1个
键、1个![]() 键; C2H4结构简式为CH2=CH2,有5个
键; C2H4结构简式为CH2=CH2,有5个![]() 键和1个
键和1个![]() 键,
键,![]() 键和
键和![]() 键数目之比为5:1。
键数目之比为5:1。
(3)根据晶胞图,与每个O原子离的最近的Ti原子有3个,TiO2晶体中O原子的配位数是3;根据均摊原则,1个晶胞中含有O原子数是![]() 、含有Ti原子数是
、含有Ti原子数是![]() ,1mol晶胞的质量是(48×2+16×4)g,a=b=459pm,c=295pm,1个晶胞的体积是459×459×295×10-30cm3,1mol晶胞的体积是459×459×295×10-30×6.02×1023 cm3,
,1mol晶胞的质量是(48×2+16×4)g,a=b=459pm,c=295pm,1个晶胞的体积是459×459×295×10-30cm3,1mol晶胞的体积是459×459×295×10-30×6.02×1023 cm3,![]() =
=![]() g/cm3 。
g/cm3 。

 阅读快车系列答案
阅读快车系列答案【题目】离子反应是中学化学中重要的反应类型.回答下列问题:
(1)人们常用图示的方法表示不同反应类型之间的关系.如分解反应和氧化还原反应可表示为下左图,下右图为离子反应、氧化还原反应和置换反应三者之间的关系,则表示离子反应、氧化还原反应、置换反应的字母分别是________。
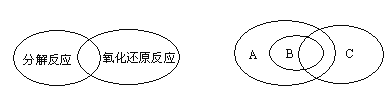
(2)将NaBr溶液加入AgCl沉淀中,产生AgBr黄色沉淀.从离子反应发生的条件分析,AgCl与AgBr相比较,溶解度较大的是________。
(3)离子方程式是重要的化学用语,下列是有关离子方程式的一些错误观点,请在下列表格中用相应的“离子方程式”否定这些观点。反应物从下列物质中选取:Na、Fe、H2O、H2SO4、HCl、NaOH、Ba(OH)2、CuCl2(已知2Na+2H2O=2NaOH+H2↑)。
错误观点 | 离子方程式 | |
① | 所有的离子方程式均可以表示一类反应 | _____ |
② | 所有酸碱中和反应均可表示为:H++OH-=H2O | _____ |
【题目】某无色混合溶液中可能含有的离子如下表所示:
可能大量含有的阳离子 | H+、Al3+、NH4+、Na+ |
可能大量含有的阴离子 | Cl-、AlO2-、SO42-、MnO4-、Br-、I-、CO32- |
为探究其成分,进行了以下探究实验。
探究一:
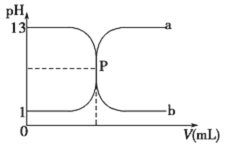
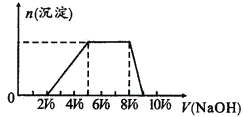
甲同学取一定量的混合溶液,用pH试纸检验,溶液pH<7;向其中逐液加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如图所示。
探究二
乙同学取一定量的混合溶液,向溶液中加氯水,无气体产生,再加入CCl4振荡、静置,CCl4层呈橙红色,用分液漏斗分液;向分液后的水溶液中加入AgNO3和HNO3混合液,有白色沉淀产生。
探究三:
另取原溶液少量加入Ba(NO3)2和盐酸的混合液,产生白色沉淀。
(1)该溶液中一定含有的阴离子是___;其中能确定离子浓度之比的,对应离子物质的量浓度之比为___;不能肯定是否含有的离子是___。确定其中阳离子的实验方法为___。
(2)请写出沉淀减少过程中发生反应的离子方程式___。