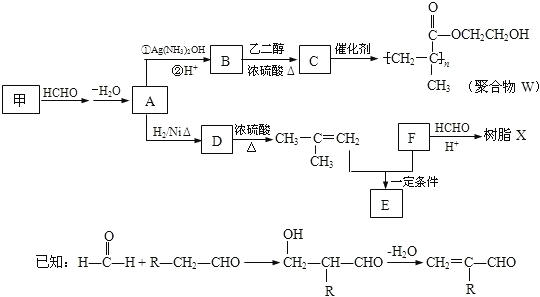
题目内容
【题目】某无色混合溶液中可能含有的离子如下表所示:
可能大量含有的阳离子 | H+、Al3+、NH4+、Na+ |
可能大量含有的阴离子 | Cl-、AlO2-、SO42-、MnO4-、Br-、I-、CO32- |
为探究其成分,进行了以下探究实验。
探究一:
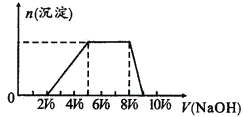
甲同学取一定量的混合溶液,用pH试纸检验,溶液pH<7;向其中逐液加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如图所示。
探究二
乙同学取一定量的混合溶液,向溶液中加氯水,无气体产生,再加入CCl4振荡、静置,CCl4层呈橙红色,用分液漏斗分液;向分液后的水溶液中加入AgNO3和HNO3混合液,有白色沉淀产生。
探究三:
另取原溶液少量加入Ba(NO3)2和盐酸的混合液,产生白色沉淀。
(1)该溶液中一定含有的阴离子是___;其中能确定离子浓度之比的,对应离子物质的量浓度之比为___;不能肯定是否含有的离子是___。确定其中阳离子的实验方法为___。
(2)请写出沉淀减少过程中发生反应的离子方程式___。
【答案】Br- 、SO42- c(H+) :c(NH4+):c(Al3+)=2:3:1 Na+、Cl- 焰色反应 Al(OH)3+OH-═AlO2-+2H2O
【解析】
无色混合溶液中不能含有MnO4-;
由探究一知,溶液的pH<7,开始加入2V0NaOH无沉淀生成说明发生的反应是:H++OH-═H2O,有H+,则无AlO2-、CO32-;再加入氢氧化钠溶液至5V0,生成沉淀增多至最大,反应为Al3++3OH-═Al(OH)3↓,有Al3+,此过程消耗氢氧化钠溶液3V0;继续加入氢氧化钠,沉淀量不变,说明氢氧化钠和溶液中的铵根离子反应:NH4++OH-=NH3H2O,消耗氢氧化钠溶液3V0;继续加入氢氧化钠溶液,沉淀开始溶解,到加入9V0氢氧化钠溶液,沉淀全部溶解,发生的反应为Al(OH)3+OH-═AlO2-+2H2O,消耗氢氧化钠的体积V0;
根据探究二,向溶液中加氯水,无气体产生,说明无CO32-,再加入CCl4振荡、静置,CCl4层呈橙红色,说明有Br-,不含I-;用分液漏斗分液,向分液后的水溶液中加入AgNO3和HNO3混合液,有白色沉淀产生,说明分液后的水溶液中有Cl-,因为加入的氯水被还原成Cl-,不能确定原混合液中是否含Cl-;
根据探究三,加入少量Ba(NO3)2和盐酸的混合液,产生白色沉淀,说明原混合液中有SO42-;
综上分析,混合溶液中一定含有的离子:H+、Al3+、NH4+、Br-、SO42-,一定不含的离子:MnO4-、CO32-、I-、AlO2-,可能含有的离子:Na+、Cl-。
无色混合溶液中不能含有MnO4-;
由探究一知,溶液的pH<7,开始加入2V0NaOH无沉淀生成说明发生的反应是:H++OH-═H2O,有H+,则无AlO2-、CO32-;再加入氢氧化钠溶液至5V0,生成沉淀增多至最大,反应为Al3++3OH-═Al(OH)3↓,有Al3+,此过程消耗氢氧化钠溶液3V0;继续加入氢氧化钠,沉淀量不变,说明氢氧化钠和溶液中的铵根离子反应:NH4++OH-=NH3H2O,消耗氢氧化钠溶液3V0;继续加入氢氧化钠溶液,沉淀开始溶解,到加入9V0氢氧化钠溶液,沉淀全部溶解,发生的反应为Al(OH)3+OH-═AlO2-+2H2O,消耗氢氧化钠的体积V0;
根据探究二,向溶液中加氯水,无气体产生,说明无CO32-,再加入CCl4振荡、静置,CCl4层呈橙红色,说明有Br-,不含I-;用分液漏斗分液,向分液后的水溶液中加入AgNO3和HNO3混合液,有白色沉淀产生,说明分液后的水溶液中有Cl-,因为加入的氯水被还原成Cl-,不能确定原混合液中是否含Cl-;
根据探究三,加入少量Ba(NO3)2和盐酸的混合液,产生白色沉淀,说明原混合液中有SO42-;
(1)该溶液中一定含有的阴离子:Br-、SO42-;其中能确定离子浓度之比的是H+、NH4+、Al3+,根据它们消耗的NaOH溶液的体积和相应的离子方程式,c(H+):c(NH4+):c(Al3+)=2V0:3 V0:V0=2:3:1;不能肯定是否含有的离子:Na+、Cl-;确定是否含Na+的实验方法为:焰色反应;
(2)沉淀减少过程为Al(OH)3与NaOH的反应,反应的离子方程式:Al(OH)3+OH-═AlO2-+2H2O。

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案