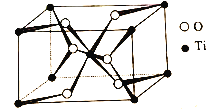
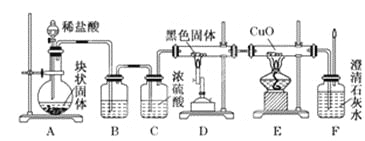
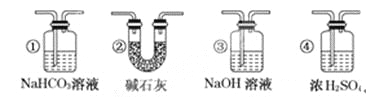
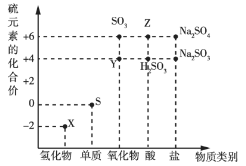
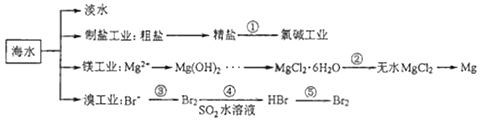
题目内容
【题目】常温下,盐酸与氢氧化钠溶液相互滴定的滴定曲线如下图,下列叙述不正确的是
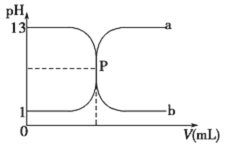
A. 滴定过程的任何时刻都存在:c(H+)+ c(Na+)=c(OH-)+c(Cl-)
B. 曲线b是用氢氧化钠溶液滴定盐酸溶液的滴定曲线
C. 氢氧化钠溶液的物质的量浓度为0.1molL-1
D. P点时恰好完全中和,溶液呈中性
【答案】B
【解析】试题分析:A、盐酸与氢氧化钠溶液相互滴定,溶液中存在的离子有H+、Na+、OH-、Cl-,根据电荷守恒,任何时刻都存在:c(H+)+ c(Na+)=c(OH-)+c(Cl-),A正确;B、曲线b的pH是由大到小,说明是盐酸溶液滴定氢氧化钠溶液的曲线,B错误;C、由曲线可知氢氧化钠溶液的pH=13,所以氢氧化钠溶液的物质的量浓度为0.1molL-1,C正确;D、由曲线可知P点时pH=7,说明溶液呈中性,反应恰好完全,D正确。答案选B。

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目