题目内容
【题目】下列实验过程不能达到实验目的的是
编号 | 实验目的 | 实验过程 |
A | 测定NaOH溶液的浓度 | 用酸式滴定管量取20.00mL待测NaOH溶液,用甲基橙作指示剂,用标准浓度的盐酸进行滴定 |
B | 提高饱和氯水中的HClO浓度 | 向饱和氯水中加入碳酸钙粉末并通入适量Cl2,然后过滤 |
C | 加快铁片与盐酸的反应速率 | 向反应液中滴人几滴CuCl2溶液 |
D | 比较CdS(黄色)与CuS(黑色)的溶解度(已知 | 向H2S溶液中滴加0.01mol·L-1的CdSO4溶液至沉淀不再增加,然后滴入几滴0.01 mol·L-1CuSO4溶液,观察沉淀颜色变化 |
A. AB. BC. CD. D
【答案】A
【解析】
A、量取NaOH溶液应用碱式滴定管;
B、Cl2+H2O![]() H++C1-+HClO,是可逆反应,加入的CaCO3会与HCl反应而不与HClO反应;
H++C1-+HClO,是可逆反应,加入的CaCO3会与HCl反应而不与HClO反应;
C、形成Fe一Cu原电池;
D、由较难溶沉淀可转化为更难溶沉淀。
A、量取NaOH溶液应用碱式滴定管,故A项符合题意;
B、Cl2+H2O![]() H++C1-+HClO,加入的CaCO3会与HCl反应而不与HClO反应,再通入Cl2,均使平衡右移,故B项不符合题意;
H++C1-+HClO,加入的CaCO3会与HCl反应而不与HClO反应,再通入Cl2,均使平衡右移,故B项不符合题意;
C、形成Fe一Cu原电池,反应速率加快,故C项不符合题意;
D、由较难溶沉淀可转化为更难溶沉淀,所以通过观察沉淀是否由黄色变为黑色可比较CdS与CuS的溶解度,故D项不符合题意。
故选A。

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案【题目】我国是世界上最早制得和使用金属锌的国家。一种以闪锌矿(主要成份是ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:

相关金属离子[c(Mn+)=0.10mol·L–1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ |
开始沉淀的pH | 1.5 | 6.3 | 6.3 | 7.4 |
沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 |
回答下列问题:
(1)写出ZnS的电子式__________________________;
焙烧过程中主要反应的化学方程式为__________________________。
(2)滤渣1的成分为:___________________;
(3)试剂Y是_________(只要求填写一种), 调PH值的范围是___________________。
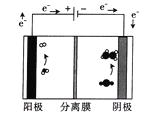
(4)电解硫酸锌溶液制备单质锌时,电解的总反应离子方程式为:___________________。
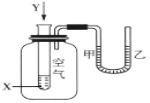
(5)为将溶液中的Fe2+氧化,试剂X可选用的是_______。(填序号)
A.H2O2 B.H2S C.HNO3 D.O2