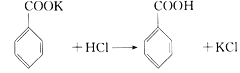
题目内容
【题目】在一定条件下,对于密闭容器中进行的可逆反应A(g)+ 3B(g)![]() 2C(g), 下列说法能证明这一 反应已经达到化学平衡状态的是
2C(g), 下列说法能证明这一 反应已经达到化学平衡状态的是
A.生成C的速率与分解C的速率相等.
B.A. B、C的分子数之比为1:3:2
C.A、B、C的浓度相等
D.单位时间消耗nmolA,同时生成2nmolC
【答案】A
【解析】
题目中的反应A(g)+ 3B(g)![]() 2C(g)是可逆反应,判定平衡的直接判据是
2C(g)是可逆反应,判定平衡的直接判据是![]() ,间接判据是变量不变。
,间接判据是变量不变。
A.生成C的速率与C分解的速率相等表明正逆反应速率相等,符合![]() ,达到了平衡状态, A正确;
,达到了平衡状态, A正确;
B.各组分分子数成比例不能证明各组分的浓度不变,无法判断是否达到了平衡状态,B错误;
C.各组分的浓度相等不能证明各组分的浓度不变,无法判断是否达到平衡状态,C错误;
D.消耗nmolA是正反应方向,生成2nmolC也是正反应方向,没有体现出![]() , D错误;
, D错误;
故选A。

【题目】下列实验过程不能达到实验目的的是
编号 | 实验目的 | 实验过程 |
A | 测定NaOH溶液的浓度 | 用酸式滴定管量取20.00mL待测NaOH溶液,用甲基橙作指示剂,用标准浓度的盐酸进行滴定 |
B | 提高饱和氯水中的HClO浓度 | 向饱和氯水中加入碳酸钙粉末并通入适量Cl2,然后过滤 |
C | 加快铁片与盐酸的反应速率 | 向反应液中滴人几滴CuCl2溶液 |
D | 比较CdS(黄色)与CuS(黑色)的溶解度(已知 | 向H2S溶液中滴加0.01mol·L-1的CdSO4溶液至沉淀不再增加,然后滴入几滴0.01 mol·L-1CuSO4溶液,观察沉淀颜色变化 |
A. AB. BC. CD. D
【题目】钇的常见化合价为+3价,我国蕴藏着丰富的含钇矿石(Y2FeBe2Si2O10),工业上通过如下生产流程可获得氧化钇。

已知:①该流程中有关金属离子形成氢氧化物沉淀时的pH见下表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe3+ | 2.1 | 3.1 |
Y3+ | 6.0 | 8.2 |
②在元素周期表中,铍元素和铝元素处于第二周期和第三周期的对角线位置,化学性质相似。
(1)写出Na2SiO3的一种用途________________________。
(2)欲从Na2SiO3和Na2BeO2混合溶液中制得Be(OH)2沉淀。
① 最好选用盐酸和_______两种试剂,再通过必要的操作即可实现。
A.NaOH溶液 B.氨水 C.CO2 D.HNO3
② 写出Na2BeO2与足量盐酸发生反应的离子方程式___________________________。
(3)常温下,反应Fe3++3H2O(g) ![]() Fe (OH)3↓+3H+的平衡常数K= ______。为使Fe3+沉淀完全,用氨水调节pH=a时,a应控制在_________范围内;继续加氨水调节pH =b发生反应的离子方程式为____________________________。
Fe (OH)3↓+3H+的平衡常数K= ______。为使Fe3+沉淀完全,用氨水调节pH=a时,a应控制在_________范围内;继续加氨水调节pH =b发生反应的离子方程式为____________________________。
(4)煅烧草酸钇时发生分解反应,其固体产物为氧化钇,气体产物能使澄清石灰水变浑浊。写出草酸钇[Y2(C2O4)3·nH2O]煅烧的化学方程式___________________________________。