题目内容
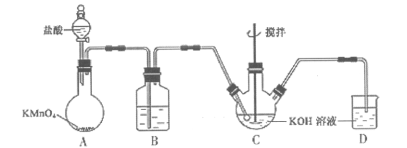
【题目】某NaCl溶液样品中含有Na2SO4、CaCl2杂质(该溶液用X表示),除去杂质的实验方案如图所示。

请回答:
(1)溶液B中存在的阳离子为____________,阴离子为___________。
(2)固体C中所含物质的化学式为__________。
(3)溶液D中加入适量盐酸后,大量减少的微粒为__________。
(4)①和②不能调换顺序的理由为______________。
【答案】Na+、Ba2+、Ca2+ Cl- BaCO3、CaCO3 CO32- ①和②调换顺序后可除去Ca2+和SO42-,但加入BaCl2溶液后引入的Ba2+杂质无法除去。
【解析】
由题意可知溶液中主要存在Na+、Ca2+、Cl-、SO42-,加BaCl2可以将SO42-沉淀,固体A为BaSO4,溶液B中有Na+、Ca2+、Cl-、Ba2+;再加Na2CO3,可将Ca2+、Ba2+沉淀下来,固体C为BaCO3、CaCO3,溶液D中有Na+、Cl-、CO32-;再加盐酸,与CO32-反应,溶液中只剩Na+和Cl-。
(1)根据分析,溶液B中存在的阳离子为Na+、Ca2+、Ba2+;阴离子为C1-;
(2)根据分析,沉淀为BaCO3、CaCO3;
(3)根据分析,加入盐酸,H+与CO32-反应,所以大量减少的离子为CO32-;
(4) CO32-除了能够出去原溶液中的Ca2+之外,还能出去加入的Ba2+,如果将①和②调换,不影响Ca2+和SO42-的去除,但加入BaCl2溶液后引入的Ba2+杂质无法除去。

 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案【题目】下列实验过程不能达到实验目的的是
编号 | 实验目的 | 实验过程 |
A | 测定NaOH溶液的浓度 | 用酸式滴定管量取20.00mL待测NaOH溶液,用甲基橙作指示剂,用标准浓度的盐酸进行滴定 |
B | 提高饱和氯水中的HClO浓度 | 向饱和氯水中加入碳酸钙粉末并通入适量Cl2,然后过滤 |
C | 加快铁片与盐酸的反应速率 | 向反应液中滴人几滴CuCl2溶液 |
D | 比较CdS(黄色)与CuS(黑色)的溶解度(已知 | 向H2S溶液中滴加0.01mol·L-1的CdSO4溶液至沉淀不再增加,然后滴入几滴0.01 mol·L-1CuSO4溶液,观察沉淀颜色变化 |
A. AB. BC. CD. D