题目内容
【题目】乙炔、乙烯均是重要的化工原料。回答下列问题:
(1)1902年,Sabatier首次发现,常压下过渡金属可以催化含有双键或叁键的气态烃的加氢反应。
①已知:C2H2(g)+H2(g)═C2H4(g)△H1=-174.3kJ·mol—1
K1(300K)=3.37×1024
C2H2(g)+2H2(g)=C2H6(g)△H2═-311.0kJ·mol一l
K2(300K)═1.19×1042
则反应C2H4(g)+H2(g)═C2H6(g)的△H=___kJ·mol一1,K(300K)=__(保留三位有效数字)。
②2010年Sheth等得出乙炔在Pd表面选择加氢的反应机理(如图)。其中吸附在Pd表面上的物种用*标注。
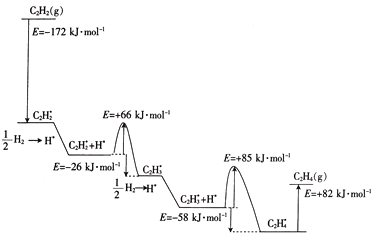
上述吸附反应为____(填“放热”或“吸热”)反应,该历程中最大能垒(活化能)为____kJ·mol-1,该步骤的化学方程式为____。
(2)在恒容密闭容器中充入乙烯,一定条件下发生反应C2H4(g)C2H2(g)+H2(g)。乙烯的离解率为a,平衡时容器内气体总压强为P总,则分压p(C2H4)═___(用p总和a表示)。
(3)用如图装置电解含CO2的某酸性废水溶液,阴极产物中含有乙烯。
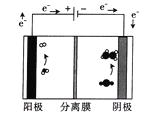
该分离膜为___(填“阳”或“阴”)离子选择性交换膜;生成乙烯的电极反应式为___。
【答案】-136.7 3.53×1017 放热 +85 C2H3*+H*→C2H4* ![]() 阳 2CO2+12H++12e-=C2H4+4H2O
阳 2CO2+12H++12e-=C2H4+4H2O
【解析】
(1)①根据盖斯定律,△H2-△H1可得C2H4(g)+H2(g)═C2H6(g)的△H,K=![]() ;
;
②吸附时能量降低,解吸时能量升高,C2H3*+H*→C2H4*的活化能最大,为+85kJ·mol-1;
(2)根据三段式列式求解;平衡分压:p(C2H4)=n(C2H4)/n总 P总;
(3)阳极发生反应:2H2O一4e-=4H++O2↑,生成的H+向阴极移动,故用阳离子选择性交换膜,在阳极CO2得到电子结合H+生成一系列燃料,其中生成乙烯的电极反应为2CO2+12H++12e-=C2H4+4H2O。
(1)①C2H4(g)+H2(g)═C2H6(g)的△H=△H2-△H1=-136.7kJ·mol-1,300K时的平衡常数K=![]() =1.19×1042/3.37×1024=3.53×1017。
=1.19×1042/3.37×1024=3.53×1017。
②由图可知,吸附时能量降低,解吸时能量升高,如C2H4*→C2H4 △H=+82kJ·mol-1,基元反应中,C2H3*+H*→C2H4*的活化能最大,为+85kJ·mol-1。
(2)由反应:C2H4(g)![]() C2H2(g)+H2(g)
C2H2(g)+H2(g)
起始/mol n 0 0
转化/mol ![]()
![]()
![]()
平衡/mol ![]()
![]()
![]()
平衡时总物质的量:![]() ,
,
平衡分压:p(C2H4)=![]() 。
。
(3)阳极发生反应:2H2O一4e-=4H++O2↑,生成的H+向阴极移动,故用阳离子选择性交换膜,在阳极CO2得到电子结合H+生成一系列燃料,其中生成乙烯的电极反应为2CO2+12H++12e-=C2H4+4H2O。

 轻松暑假总复习系列答案
轻松暑假总复习系列答案【题目】下列实验过程不能达到实验目的的是
编号 | 实验目的 | 实验过程 |
A | 测定NaOH溶液的浓度 | 用酸式滴定管量取20.00mL待测NaOH溶液,用甲基橙作指示剂,用标准浓度的盐酸进行滴定 |
B | 提高饱和氯水中的HClO浓度 | 向饱和氯水中加入碳酸钙粉末并通入适量Cl2,然后过滤 |
C | 加快铁片与盐酸的反应速率 | 向反应液中滴人几滴CuCl2溶液 |
D | 比较CdS(黄色)与CuS(黑色)的溶解度(已知 | 向H2S溶液中滴加0.01mol·L-1的CdSO4溶液至沉淀不再增加,然后滴入几滴0.01 mol·L-1CuSO4溶液,观察沉淀颜色变化 |
A. AB. BC. CD. D
【题目】钇的常见化合价为+3价,我国蕴藏着丰富的含钇矿石(Y2FeBe2Si2O10),工业上通过如下生产流程可获得氧化钇。

已知:①该流程中有关金属离子形成氢氧化物沉淀时的pH见下表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe3+ | 2.1 | 3.1 |
Y3+ | 6.0 | 8.2 |
②在元素周期表中,铍元素和铝元素处于第二周期和第三周期的对角线位置,化学性质相似。
(1)写出Na2SiO3的一种用途________________________。
(2)欲从Na2SiO3和Na2BeO2混合溶液中制得Be(OH)2沉淀。
① 最好选用盐酸和_______两种试剂,再通过必要的操作即可实现。
A.NaOH溶液 B.氨水 C.CO2 D.HNO3
② 写出Na2BeO2与足量盐酸发生反应的离子方程式___________________________。
(3)常温下,反应Fe3++3H2O(g) ![]() Fe (OH)3↓+3H+的平衡常数K= ______。为使Fe3+沉淀完全,用氨水调节pH=a时,a应控制在_________范围内;继续加氨水调节pH =b发生反应的离子方程式为____________________________。
Fe (OH)3↓+3H+的平衡常数K= ______。为使Fe3+沉淀完全,用氨水调节pH=a时,a应控制在_________范围内;继续加氨水调节pH =b发生反应的离子方程式为____________________________。
(4)煅烧草酸钇时发生分解反应,其固体产物为氧化钇,气体产物能使澄清石灰水变浑浊。写出草酸钇[Y2(C2O4)3·nH2O]煅烧的化学方程式___________________________________。