题目内容
【题目】将3.84 g的铜加入100 mL H2SO4和HNO3混合液中,铜全部溶解并放出无色气体。向溶液中加入2.70 g铝粉,充分反应后过滤,得到溶液X、滤渣Y和气体Z,气体Z遇空气不变色,在标准状况下的体积为672 mL。下列说法正确的是
A. 溶解铝粉的质量为0.54 g
B. 滤渣Y中可能只含有Cu
C. 原混合液中的c(H2SO4):c(HNO3)=9:4
D. 若向溶液X中加入100 mL 2.0 mol·L-1氢氧化钠溶液,充分反应,所得沉淀为4.68 g
【答案】C
【解析】
根据已知条件可知,n(Cu)=![]() =0.06mol,铜与 H2SO4和HNO3混合液反应的离子反应方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,消耗n(NO3-)=n(HNO3)=0.04mol,再向该溶液中加入金属铝2.70g计算得到n(Al)=
=0.06mol,铜与 H2SO4和HNO3混合液反应的离子反应方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,消耗n(NO3-)=n(HNO3)=0.04mol,再向该溶液中加入金属铝2.70g计算得到n(Al)=![]() ,充分反应后过滤,得到溶液X、滤渣Y和气体Z,气体Z遇空气不变色,说明该气体是H2,在标准状况下的体积为672 mL,即n(H2)=0.03mol,发生离子反应为:2Al+6H+=2Al3++3H2↑,2Al+3Cu2+=2Al3++3Cu,可得到生成氢气消耗金属铝0.02mol,置换反应消耗金属铝0.04mol,所以金属铝有剩余,则滤渣的成分含有金属铝和铜,
,充分反应后过滤,得到溶液X、滤渣Y和气体Z,气体Z遇空气不变色,说明该气体是H2,在标准状况下的体积为672 mL,即n(H2)=0.03mol,发生离子反应为:2Al+6H+=2Al3++3H2↑,2Al+3Cu2+=2Al3++3Cu,可得到生成氢气消耗金属铝0.02mol,置换反应消耗金属铝0.04mol,所以金属铝有剩余,则滤渣的成分含有金属铝和铜,
A.根据上述分析可知,一共消耗金属铝的物质的量为:0.02mol+0.04mol=0.06mol,即消耗铝的质量为:0.06mol×27g/mol=1.62g,故A错误;
B.由分析可知,铝粉有剩余,且置换反应有铜生成,所以滤渣含有铝和铜,故B错误;
C. 根据已知条件可知,n(Cu)=![]() =0.06mol,铜与 H2SO4和HNO3混合液反应的离子反应方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,消耗n(NO3-)=n(HNO3)=0.04mol,c(HNO3)=
=0.06mol,铜与 H2SO4和HNO3混合液反应的离子反应方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,消耗n(NO3-)=n(HNO3)=0.04mol,c(HNO3)=![]() =
=![]() =0.4mol/L,反应前后n(SO42-)不变,其中生成n(Al3+)=0.06mol,即n(SO42-)=
=0.4mol/L,反应前后n(SO42-)不变,其中生成n(Al3+)=0.06mol,即n(SO42-)=![]() n(Al3+)=0.09mol,所以c(H2SO4)=
n(Al3+)=0.09mol,所以c(H2SO4)=![]() 0.9mol/L,则原混合液中的c(H2SO4):c(HNO3)=9:4,故C正确;
0.9mol/L,则原混合液中的c(H2SO4):c(HNO3)=9:4,故C正确;
D.根据上述分析可知X溶液是硫酸铝溶液,且溶液中Al3+的物质的量为0.06mol,滴加氢氧化钠的物质的量为: 2.0 mol·L-1×0.1L=0.2mol,氢氧化钠过量,发生的离子反应方程式为:Al3++3OH-=Al(OH)3↓, Al(OH)3+OH-=Al3++2H2O,剩余Al(OH)30.04mol,即剩余沉淀3.12g,故D错误,
故选C。

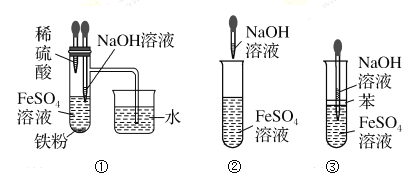
【题目】下列实验过程不能达到实验目的的是
编号 | 实验目的 | 实验过程 |
A | 测定NaOH溶液的浓度 | 用酸式滴定管量取20.00mL待测NaOH溶液,用甲基橙作指示剂,用标准浓度的盐酸进行滴定 |
B | 提高饱和氯水中的HClO浓度 | 向饱和氯水中加入碳酸钙粉末并通入适量Cl2,然后过滤 |
C | 加快铁片与盐酸的反应速率 | 向反应液中滴人几滴CuCl2溶液 |
D | 比较CdS(黄色)与CuS(黑色)的溶解度(已知 | 向H2S溶液中滴加0.01mol·L-1的CdSO4溶液至沉淀不再增加,然后滴入几滴0.01 mol·L-1CuSO4溶液,观察沉淀颜色变化 |
A. AB. BC. CD. D