题目内容
【题目】非物质文化遗产“芜湖铁画”的某些产品中含有铁、金和碳等成分(其他成分忽略不计)。某同学取一定质量的铁画废弃样品,加入100mL稀盐酸中,恰好完全反应,放出0.3gH2,剩余固体质量为0.1g。请计算:
(1)样品中铁的质量分数。
(2)稀盐酸的物质的量浓度。
【答案】放出0.3gH2,则n(H2)=![]() =0.15mol。
=0.15mol。
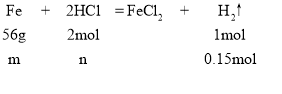
(1)![]() ,解得m=8.4g,则样品中铁的质量分数=
,解得m=8.4g,则样品中铁的质量分数=![]() =98.8%;
=98.8%;
(2)![]() ,解得n=0.3mol,则盐酸的物质的量浓度C=
,解得n=0.3mol,则盐酸的物质的量浓度C=![]() mol·L-1。
mol·L-1。
答:(1)该样品中铁的质量分数为98.8%;
(2)该盐酸的物质的量浓度为3mol·L-1。
【解析】
铁画废弃样品中含有铁、金和碳等成分,只有Fe能和盐酸反应放出氢气。
放出0.3gH2,则n(H2)=![]() =0.15mol。
=0.15mol。
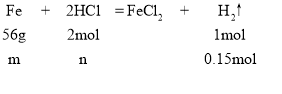
(1)列比例式有:![]() ,解得Fe的质量m=8.4g,则样品中铁的质量分数=
,解得Fe的质量m=8.4g,则样品中铁的质量分数=![]() =98.8%;
=98.8%;
(2)列比例式有:![]() ,解得HCl的物质的量n=0.3mol,则盐酸的物质的量浓度C=
,解得HCl的物质的量n=0.3mol,则盐酸的物质的量浓度C=![]() mol·L-1。
mol·L-1。
故答案为:放出0.3gH2,则n(H2)=![]() =0.15mol。
=0.15mol。
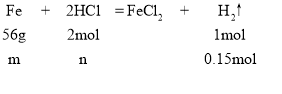
(1)![]() ,解得m=8.4g,则样品中铁的质量分数=
,解得m=8.4g,则样品中铁的质量分数=![]() =98.8%;
=98.8%;
(2)![]() ,解得n=0.3mol,则盐酸的物质的量浓度C=
,解得n=0.3mol,则盐酸的物质的量浓度C=![]() mol·L-1。
mol·L-1。
答:(1)该样品中铁的质量分数为98.8%;
(2)该盐酸的物质的量浓度为3mol·L-1。

 英才计划期末调研系列答案
英才计划期末调研系列答案【题目】某研究小组对碘化钾溶液在空气中发生氧化反应的速率进行实验探究。
(初步探究)
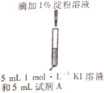
示意图 | 序号 | 温度 | 试剂A | 现象 |
| ① | 0℃ | 0.5 mol·L-1稀硫酸 | 4min左右出现蓝色 |
② | 20℃ | 1min左右出现蓝色 | ||
③ | 20℃ | 0.1 mol·L-1 稀硫酸 | 15min左右出现蓝色 | |
④ | 20℃ | 蒸馏水 | 30min左右出现蓝色 |
(1)为探究温度对反应速率的影响,实验②中试剂A应为_______ 。
(2)写出实验③中I-反应的离子方程式___________。
(3)对比实验②③④,可以得出的结论是__________。
(继续探究)溶液pH对反应速率的影响
查阅资料:
i.pH<11.7时,I-能被O2氧化为I2。
ii.pH>9.28时,I2发生歧化反应:3I2+6OH-=IO3-+5I-+3H2O,pH越大,歧化速率越快
(4)小组同学用4支试管在装有O2储气瓶中进行实验,装置如图所示:
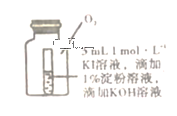
序号 | ⑤ | ⑥ | ⑦ | ⑧ |
试管中溶液的pH | 8 | 9 | 10 | 11 |
放置10小时后的现象 | 出现蓝色 | 颜色无明显变化 | ||
pH为10、11时,试管⑦和⑧中颜色无明显变化的原因是________(填序号)。
A.既发生氧化反应又发生歧化反应,歧化反应速率大于氧化反应速率和淀粉变色速率
B.既发生氧化反应又发生歧化反应,歧化反应速率小于氧化反应速率和淀粉变色速率
C.发生了氧化反应,但没有发生歧化反应
D.发生了歧化反应,但没有发生氧化反应