题目内容
【题目】工业上用电解法可用于治理亚硝酸盐对水体的污染,模拟工艺如图所示,下列说法不正确的是
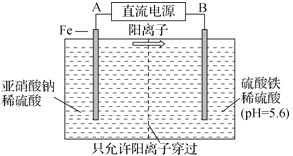
A. A、B分别为直流电源的正极和负极
B. 当电解过程转移0.6mol电子时,左侧区域质量减少1.4g
C. 电解过程中,左侧区域将依次发生反应为:Fe-2e-=Fe2+ 、2NO2-+8H++6Fe2+=N2↑+6Fe3++4H2O
D. 研究表明,当右侧区域pH较小时,会有气体逸出,该现象说明H+的氧化性强弱与其c(H+)有关
【答案】B
【解析】
A.由电解池中阳离子的移动方向可知,电解池中Fe做阳极,即A为电源正极,B为电源负极,故A正确;
B. Fe做阳极失电子发生氧化反应,电极反应为:Fe-2e-═Fe2+,亚铁离子还原亚硝酸根离子生成氮气,反应的离子方程式为:2NO2-+8H++6Fe2+═N2↑+6Fe3++4H2O,总反应为6Fe+ 2NO2-+8H+-12e-═N2↑+6Fe3++4H2O,当电解过程转移0.6mol电子时,放出的氮气为0.05mol,放出的氮气质量为0.05mol ×28g/mol=1.4g,左侧生成的部分铁离子向右侧移动,因此左侧区域质量减少大于1.4g,故B错误;
C. 根据B的分析,电解过程中,左侧区域将依次发生反应为:Fe-2e-=Fe2+、2NO2-+8H++6Fe2+=N2↑+6Fe3++4H2O,故C正确;
D. 阳离子在阴极放电,当右侧区域pH较小时,氢离子浓度大了之后,氢离子放电生成氢气,该现象表明c(H+)越大,H+氧化性越强,故D正确;
答案选B。

 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
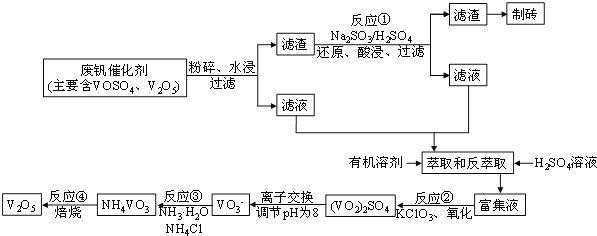
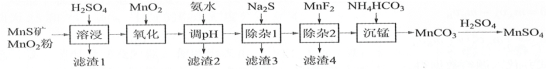
名校作业本系列答案【题目】 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式_______。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是______
(6)写出“沉锰”的离子方程式_____________________________________。
【题目】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
选项 | 实验 | 现象 | 结论 |
A | 向稀硝酸中加入少量铁粉,充分反应后滴加KSCN溶液 | 有气体生成,溶液呈血红色 | 稀硝酸将Fe氧化为Fe3+ |
B | 将铜粉加入到1.0 mol·L-1 Fe2(SO4)3溶液中 | 铜粉溶解,溶液变蓝 | 金属铁比铜活泼 |
C | 将5 mL 0.005 mol·L-1 FeCl3溶液和5 mL 0.015 mol·L-1 KSCN溶液混合,达到平衡后再滴加4滴1 mol·L-1的KCl溶液 | 溶液红色加深 | 增大反应物浓度,平衡正向移动 |
D | 向10 mL 0.1 mol·L-1 AgNO3溶液中滴加4滴0.1 mol·L-1 NaCl溶液,然后再滴加4滴0.1 mol·L-1 Na2S溶液 | 先有白色沉淀生成,后有黑色沉淀生成 | 相同温度下,Ag2S的溶度积比AgCl的小 |
A. A B. B C. C D. D