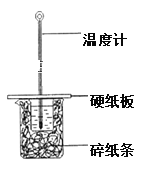
题目内容
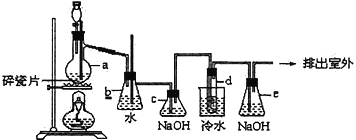
【题目】某化学兴趣小组欲验证:“铜和一定量的浓硝酸反应有一氧化氮产生”。设计使用了如图装置进行实验。(假设气体体积均为标准状况,导气管中气体体积忽略不计,且忽略反应中的溶液体积变化)

试回答下列问题:
(1)在铜和浓硝酸反应前,挤压打气球(球内充满空气),经A、B、C反应后,气体进入D中,通入该气体的目的是_______;进行此步操作时应关闭_______,打开_____(填K1、K2或K3,上同)。
(2)关闭K1、K2,打开K3,由分液漏斗向D中滴加浓硝酸。待Cu和浓硝酸反应结束后,再通过分液漏斗向D中加入CCl4至满。则D中一定发生反应的离子方程式为:___。
(3)若E装置中出现倒吸,可采取的应急操作是____________;
(4)若测得反应后E装置中HNO3的浓度为0.072mol/L,F装置所收集到的气体体积为139.00 mL,则铜和一定量的浓硝酸反应___(填“有”或“无”)NO生成。
【答案】排出D中的空气 关闭K3 打开K1、K2 Cu + 2NO3-+ 4H+=Cu2++ 2NO2↑+ 2H2O 向下调节量气管(或及时关闭K3) 有
【解析】
气球中的空气成分主要是氧气、氮气、二氧化碳、水蒸气等,通过氢氧化钠溶液除去二氧化碳,通过浓硫酸除去水蒸气;C装置是反应掉空气中的氧气;D装置是验证铜和浓硝酸反应中可能产生一氧化氮气体,必须保证不能含有氧气,才能在后续试验中通过测定气体体积判断一氧化氮气体的存在。
(1)综上分析进入D装置的气体主要是氮气,通入氮气目的是排出D中的空气,避免生成的一氧化氮气体被氧气氧化为二氧化氮,依据气体流向,关闭K3,打开K1、K2,让氮气把试管中的空气赶净,更好的利用后续试验测定气体体积和验证一氧化氮气体的生成。
(2)关闭K1、K2,打开K3,由分液漏斗向D中滴加浓硝酸,一定发生的反应是铜和浓硝酸反应生成硝酸铜、二氧化氮和水,离子方程式为Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O。
(3)若E中出现倒吸,可以调节F中量气管的液体高度改变压强,向下调节量气管,使E中的压强减少,防止液体进入E发生倒吸,或直接关闭K3,不让液体进入E装置。
(4)通过计算分析判断,E装置中生成的硝酸溶液体积为100ml,浓度为0.0720mol/L,所以生成硝酸物质的量为0.0072mol,根据化学方程式3NO2+H2O=2HNO3+NO,生成的一氧化氮气体物质的量为0.0036mol,在标准状况下的体积=0.0036mol×22.4L/mol=0.08064L
=80.64ml,加上原来试管中的氮气50ml,共计130.64ml,小于题干中实验测得的气体体积139.00ml,说明铜和浓硝酸反应的过程中生成二氧化氮气体同时也生成了一氧化氮气体。

【题目】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
选项 | 实验 | 现象 | 结论 |
A | 向稀硝酸中加入少量铁粉,充分反应后滴加KSCN溶液 | 有气体生成,溶液呈血红色 | 稀硝酸将Fe氧化为Fe3+ |
B | 将铜粉加入到1.0 mol·L-1 Fe2(SO4)3溶液中 | 铜粉溶解,溶液变蓝 | 金属铁比铜活泼 |
C | 将5 mL 0.005 mol·L-1 FeCl3溶液和5 mL 0.015 mol·L-1 KSCN溶液混合,达到平衡后再滴加4滴1 mol·L-1的KCl溶液 | 溶液红色加深 | 增大反应物浓度,平衡正向移动 |
D | 向10 mL 0.1 mol·L-1 AgNO3溶液中滴加4滴0.1 mol·L-1 NaCl溶液,然后再滴加4滴0.1 mol·L-1 Na2S溶液 | 先有白色沉淀生成,后有黑色沉淀生成 | 相同温度下,Ag2S的溶度积比AgCl的小 |
A. A B. B C. C D. D