题目内容
18. 浓硫酸在高中化学实验中有着很重要的作用
浓硫酸在高中化学实验中有着很重要的作用(1)铜与浓硫酸反应实验时,发现试管底部有白色固体并夹杂有少量黑色固体.倒去试管中的浓硫酸,将剩余固体(含少量浓硫酸)倒入盛有少量水的烧杯中,发现所得溶液为蓝色,黑色固体未溶解.过滤、洗涤后,向黑色固体中加入过量浓硝酸,黑色固体溶解,溶液呈蓝色,所得溶液加BaCl2溶液后有白色沉淀生成.则黑色固体中含有Cu、S元素.
(2)实验室利用浓硫酸分别与氯化钠固体和碘化钾固体加热反应制取所需物质,分析这两个反应中浓硫酸作用的异同点:相同点均为难挥发性的酸,不同点后者还有强氧化性.
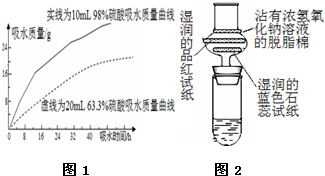
(3)探究浓硫酸的吸水性.某同学把98%的硫酸10mL和63.3%的硫酸(用10mL 98%的硫酸与10mL水配成)约20mL分别放入两个相同的大表面皿中,根据室温环境下实验的数据绘成的曲线如图.由右图曲线你能得到的实验结论有哪些?(写两点)98%硫酸和63.3%硫酸都具有吸水性、98%硫酸吸水能力比63.3%硫酸强.
(4)浓硫酸与蔗糖反应的演示实验装置修改如图 2:实验时在大试管中先放入2g细小颗粒的蔗糖,滴加2-3滴碳酸钠浓溶液,再加入1.5mL 98%的浓硫酸,迅速塞紧带干燥管的单孔橡皮塞.可以看到,蔗糖迅速变黑,体积急剧膨胀,形成多孔海绵状固体物质--“黑面包”.分析实验效果更加明显的原因:碳酸钠与浓硫酸反应及浓硫酸遇水均是放热过程,使体系温度升高,同时浓硫酸与碳酸钠反应产生二氧化碳使脱水后生成的炭更加疏松多孔.
(5)用浓硫酸吸收SO3可得发烟硫酸(H2SO4•SO3).某化工厂用1.5m3 98.3%的浓硫酸(密度为1.84g/mL)吸收SO3形成发烟硫酸,再与水混合,可得到95%的硫酸(密度为1.79g/mL)3.49m3(保留2位小数).
(6)在100mL 18mol•L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是AB(填写代号);A.7.32LB.6.72LC.20.16LD.30.24L.
分析 (1)Cu与浓H2SO4发生的主要反应为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2+2H2O,依据硫酸铜为白色的固体,倒入水中溶液为蓝色推断白色固体为硫酸铜;依据黑色固体不溶液水,加入过量浓硝酸,黑色固体溶解,溶液呈蓝色,推断黑色固体中含有铜离子;依据所得溶液加BaCl2溶液后有白色沉淀生成,推断黑色固体含有硫元素,被硝酸氧化生成硫酸根离子,加BaCl2溶液后有白色沉淀硫酸钡生成,据此推断;
(2)浓硫酸分别与氯化钠固体反应生成氯化氢,体现了浓硫酸的难挥发性;浓硫酸与固体碘化钾反应先生成碘化氢,碘化氢具有还原性,浓硫酸具有强的氧化性,发生氧化还原反应,该过程体现了浓硫酸的难挥发性和强的氧化性,据此解答;
(3)根据曲线观察两种酸的吸水情况的变化趋势进行分析;
(4)浓硫酸与碳酸钠反应为放热反应,而浓硫酸溶于水为放热过程,使体系温度升高,二氧化碳使“黑面包”膨胀;
(5)先根据浓硫酸的体积、质量分数、密度计算出含有的硫酸、水的物质的量,从而计算出发烟硫酸的物质的量,然后设与水混合后的硫酸溶液的体积为VmL,根据稀释过程中硫酸的质量不变计算出V,再将计算结果转换成单位为m3的硫酸体积即可;
(6)根据铜只能与浓硫酸反应、不与稀硫酸不反应及硫酸的量进行计算和判断.
解答 解:(1)Cu与浓H2SO4发生的主要反应为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2+2H2O,浓硫酸有剩余,硫酸铜为白色的固体,倒入水中溶液为蓝色,所以该白色固体是硫酸铜;由于浓硫酸有剩余,而CuO能溶于稀硫酸,则黑色固体不可能为CuO,又因为黑色固体溶于浓硝酸,溶液呈蓝色,说明含Cu2+,加入BaCl2溶液产生了不溶于硝酸的沉淀BaSO4,原黑色沉淀中含S元素,所以原黑色沉淀中含Cu、S两元素,
故答案为:Cu、S;
(2)浓硫酸分别与氯化钠固体反应生成氯化氢,体现了浓硫酸的难挥发性;浓硫酸与固体碘化钾反应先生成碘化氢,碘化氢具有还原性,浓硫酸具有强的氧化性,发生氧化还原反应,该过程体现了浓硫酸的难挥发性和强的氧化性,故这两个反应中浓硫酸作用相同点是:浓硫酸具有难挥发性,不同点是后者还表现了浓硫酸的强的氧化性,
故答案为:相同点均为难挥发性的酸,不同点后者还有强氧化性;
(3)根据图示可以看出:开始两种算的吸水速率差异较大,随着时间的推移,吸水速度越来越接近,吸水能力越来越弱,硫酸浓度越小,吸水能力越弱,当达到一定浓度时,失去吸水能力,硫酸的吸水能力可能受温度、湿度、气压以及酸的物质的量的影响,
故答案为:98%硫酸和63.3%硫酸都具有吸水性;98%硫酸吸水能力比63.3%硫酸强;
(4)因浓硫酸与碳酸钠反应为放热反应,而浓硫酸溶于水为放热过程,使体系温度升高,则浓硫酸使蔗糖脱水变为“黑面包”,同时浓硫酸与碳酸钠反应生成的二氧化碳使脱水后生成的炭更加疏松多孔,所以实验现象更加明显,
故答案为:碳酸钠与浓硫酸反应及浓硫酸遇水均是放热过程,使体系温度升高,同时浓硫酸与碳酸钠反应产生二氧化碳使脱水后生成的炭更加疏松多孔;
(5)1.5m3 98.3%的浓硫酸(密度为1.84g/mL)中含有硫酸的质量为:m(H2SO4)=1.5×106mL×1.84g/mL×98.3%≈2.713×106g,硫酸的物质的量为:$\frac{2.713×1{0}^{6}g}{98g/mol}$≈2.769×104mol,
1.5m3 98.3%的浓硫酸(密度为1.84g/mL)中含有水的质量为:1.5×106mL×1.84g/mL×(1-98.3%)=4.692×104g,水的物质的量为:$\frac{4.692×1{0}^{4}g}{18g/mol}$≈2.607×103mol,水与三氧化硫反应生成硫酸的物质的量等于水的物质的量,
所以用水吸收后形成发烟硫酸的物质的量为:2.769×104mol+2.607×103mol=3.0297×104mol,
用水稀释后的溶液中含有硫酸的物质的量为:2×3.0297×104mol=6.0294×104mol,
设稀释后溶液的体积为VmL,则:VmL×1.79g/mL×95%=6.0294×105mol×98g/mol,
解得:V≈3.49×106mL=3.49m3,
故答案为:3.49;
(6)铜只能与浓硫酸反应,与稀硫酸不反应,Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+H2O,浓硫酸的物质的量为:0.1L×18mol/L=1.8mol,如被还原的硫酸是0.9mol,则生成n(SO2)=0.9mol,V(SO2)=0.9mol×22.4L/mol=20.16L,但随着铜和浓硫酸的反应的进行,酸的浓度越来越小,不再产生二氧化硫,则生成二氧化硫的体积小于20.16L,AB都符合,
故答案为:AB.
点评 本题考查了硫酸的性质及计算,题目难度中等,试题题量较大、知识点较多、计算量较大,充分考查了学生的分析、理解能力及化学实验、化学计算能力,注意掌握浓硫酸的性质,明确有关化学方程式的计算方法.

 名校课堂系列答案
名校课堂系列答案| A. | 恒温下向溶液中加CaO,溶液的pH升高 | |
| B. | 给溶液加热,溶液的pH升高 | |
| C. | 恒温下向溶液中加入CaO后,溶液中的c(OH-)不变 | |
| D. | 向溶液中加入少量的NaOH固体,Ca(OH)2固体的质量不变 |
 某混合溶液中可能含有的离子如下表所示:
某混合溶液中可能含有的离子如下表所示:| 可能大量含有的阳离子 | H+、Ag+、Mg2+、Al3+、NH4+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32-、AlO2- |
(1)探究一:
甲同学取一定量的混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如图所示.
①该溶液中一定不存在的阳离子是Mg2+、Fe3+、Ag+,一定不存在的阴离子是CO32-、AlO2-;含有的阳离子其对应物质的量浓度之比为H+、NH4+、Al3+为2:3:1;
②请写出沉淀减少过程中发生反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(2)探究二:
乙同学检测到该溶液中含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
| Cl2的体积(标准状况) | 11.2L | 22.4L | 28.0L |
| n(Cl-) | 2.5mol | 3.5mol | 4.0mol |
| n(Br-) | 3.0mol | 2.5mol | 2.0mol |
| n(I-) | x mol | 0 | 0 |
②原溶液中Cl-、Br-、I-的物质的量浓度之比为1:2:1.
| 选项 | 实验事实 | 推论 |
| A | H2O的沸点比H2S的沸点高 | 非金属性:O>S |
| B | 盐酸的酸性比H2SO3的酸性强 | 非金属性:Cl>S |
| C | 钾与水的反应比钠与水的反应更剧烈 | 金属性:Na>K |
| D | HF的热稳定性比HCl的强 | 非金属性:F>Cl |
| A. | A | B. | B | C. | C | D. | D |
| A. | 产物所具有的总能量高于反应物所具有的总能量 | |
| B. | 反应物所具有的总能量高于产物所具有的总能量 | |
| C. | 断开1mol H-H键和1mol Cl-Cl键所吸收的总能量小于形成1mol H-Cl键所放出的能量 | |
| D. | 该反应中,热能转变为化学能 |
| A. | v(A)=0.3 mol/(L•min) | B. | v(B)=0.6 mol/(L•min) | ||
| C. | v(A)=0.01 mol/(L•s) | D. | v(C)=0.5 mol/(L•min) |

 .
.