题目内容
15.丁烯是仅次于乙烯和丙烯的重要石油化工基本原料,目前已开发出丁烷脱氢制丁烯,Pt-Sn分子筛脱氢催化剂(催化剂L-78)是该过程常用的催化剂.其反应原理为(反应Ⅰ):C4H10(g)?C4H8(g)(丁烯)+H2(g)△H1
副反应为(反应Ⅱ):C4H10(g)?C4H6(g)(丁二烯)+2H2(g)△H2
已知C4H10(g)、C4H8(g)、H2(g)的标准燃烧热(△H)为a kJ•mol-1、b kJ•mol-1、c kJ•mol-1,a<b<c<0,且a>b+c.
(1)△H1=(a-b-c)KJ/mol;反应Ⅰ能自发进行的条件是高温.(填“高温”、“低温”或“任意温度”)
(2)对于气相反应,用某组分(B)的平衡压强(Pa)代替物质的量浓度(cB)也可表示平衡常数(记作Kp),则反应Ⅱ的Kp$\frac{{P}^{2}({H}_{2})•P({C}_{4}{H}_{6})}{P({C}_{4}{H}_{10})}$;已知△H1<△H2,则随着温度升高,反应C4H8(g)(丁烯)?C4H6(g)(丁二烯)+H2(g)的平衡常数增大(填“增大”、“减小”或“不变”)
(3)在某恒温恒容密闭容器中发生反应Ⅰ和反应Ⅱ,则下列不能判断两反应已同时达到平衡的是( )
A.密闭容器中混合气体的密度不变
B.容器中$\frac{n({H}_{2})}{n({C}_{4}{H}_{10})}$不再变化
C.容器中丁二烯的浓度不再变化
D.容器中C4H8(g)体积分数不变.
分析 (1)写出C4H10(g)、C4H8(g)、H2(g)的标准燃烧热的热化学方程式,再利用盖斯定求算△H1;△H-T△S<0的反应能够自发进行;
(2)据化学平衡常数表达式,代入Pa可得;反应Ⅱ-反应Ⅰ可得反应C4H8(g)(丁烯)?C4H6(g)(丁二烯)+H2(g),其△H=△H2-△H1,已知△H1<△H2,所以△H>0,反应吸热,据此分析;
(3)反应达到平衡状态时,正逆反应速率相等,各组分浓度保持不变,据此分析.
解答 解:(1)已知①C4H10(g)+6.5O2(g)=4CO2(g)+5H2O(l)△H=akJ/mol,②C4H8(g)+6O2(g)=4CO2(g)+4H2O(l)△H=bkJ/mol,③H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=ckJ/mol.据盖斯定律①-②-③得:C4H10(g)?C4H8(g)(丁烯)+H2(g)△H1=(a-b-c)KJ/mol;反应Ⅰ能自发进行,说明其△H-T△S<0,该反应的△s>0,a<b<c<0,且a>b+c,说明△H1>0,改反应在高温下能够自发进行,故答案为:(a-b-c)KJ/mol;高温;
(2)据化学平衡常数表达式,代入Pa后Kp=$\frac{{P}^{2}({H}_{2})•P({C}_{4}{H}_{6})}{P({C}_{4}{H}_{10})}$,反应Ⅱ-反应Ⅰ可得反应C4H8(g)(丁烯)?C4H6(g)(丁二烯)+H2(g),其△H=△H2-△H1,已知△H1<△H2,所以△H>0,反应吸热,升温平衡正向移动,平衡常数增大,故答案为:$\frac{{P}^{2}({H}_{2})•P({C}_{4}{H}_{6})}{P({C}_{4}{H}_{10})}$;增大;
(3)A、恒温恒容密闭容器说明容器体积不变,混合气体质量守恒,所以密度始终不变,密度不变不能说明反应达到平衡状态,故A选;
B、容器中$\frac{n({H}_{2})}{n({C}_{4}{H}_{10})}$不再变化,说明各组分浓度不变,反应达到平衡状态,故B不选;
C、容器中丁二烯的浓度不再变化,说明各组分浓度都不变,反应达到平衡状态,故C不选;
D、容器中C4H8(g)体积分数不变,说明各组分浓度不变,反应达到平衡状态,故D不选;
故答案为:A.
点评 本题考查了盖斯定律的应用、反应自发进行的条件、平衡状态的判断,题目难度不大.

 阅读快车系列答案
阅读快车系列答案 把一块镁铝合金投入到1mol/L酸中,待合金完全溶解后,再往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液的体积变化的关系如图所示,下列说法中错误的是( )
把一块镁铝合金投入到1mol/L酸中,待合金完全溶解后,再往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液的体积变化的关系如图所示,下列说法中错误的是( )| A. | 盐酸的体积为80ml | B. | a的取值范围为0≤a<50 | ||
| C. | n(Mg2+)<0.025mol | D. | 当a值为30时,b值为0.01 |

①S、SO2 ②AlCl3、Al(OH)3 ③H2S、S ④Fe、FeCl2.
| A. | ①②③ | B. | ②③ | C. | ②④ | D. | ①③④ |
| 加入物质 | HCl(aq) | FeCl3 | NaOH | HCOONa | C2H5OH |
| 溶液的pH | 3 | 4 | 10 | 11 | 未确定 |
| 水的电离程度 | α1 | α2 | α3 | α4 | α5 |
| A. | α3>α1>α5>α2>α4 | B. | α4>α2>α5>α1>α3 | C. | α4>α2>α5>α3>α1 | D. | α1>α3>α5>α2>α4 |
| A. | 氢有三种核素:H、D、T | B. | S2-的结构示意图: | ||
| C. | 乙烯的结构简式:CH2CH2 | D. | CO2分子的结构式:O=C=O |

 .
. 也可与Ⅲ发生类似反应③的反应,生成有机物V,V的结构简式是
也可与Ⅲ发生类似反应③的反应,生成有机物V,V的结构简式是 .
.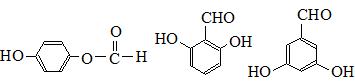 (任写一种).
(任写一种).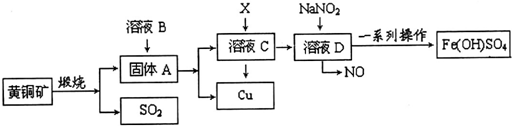

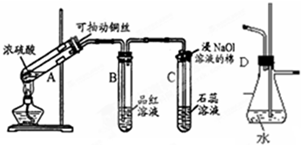 根据如图所示实验回答下列问题:
根据如图所示实验回答下列问题: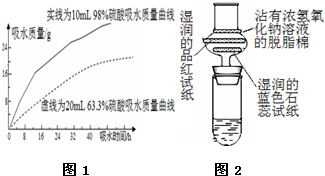 浓硫酸在高中化学实验中有着很重要的作用
浓硫酸在高中化学实验中有着很重要的作用