题目内容
7.对于放热反应H2+Cl2=2HCl,下列说法正确的是( )| A. | 产物所具有的总能量高于反应物所具有的总能量 | |
| B. | 反应物所具有的总能量高于产物所具有的总能量 | |
| C. | 断开1mol H-H键和1mol Cl-Cl键所吸收的总能量小于形成1mol H-Cl键所放出的能量 | |
| D. | 该反应中,热能转变为化学能 |
分析 A、根据活泼金属和活泼非金属之间易形成离子键,非金属元素之间易形成共价键(铵盐除外);
B、根据放热反应中反应物所具有的总能量高于产物所具有的总能量;
C、根据放热反应的本质是生成物成键释放的总能量大于反应物断键吸收的总能量;
D、根据放热反应中化学能转变为热能、光能等.
解答 解:该反应是放热反应,根据能量守恒定律知,反应物所具有的总能量高于产物所具有的总能量;放热反应的本质是:生成物成键释放的总能量大于反应物断键吸收的总能量,故选B.
点评 本题主要考查了化学反应的本质以及能量变化的宏观和微观原因,难度不大.

练习册系列答案
相关题目
3.X、Y、Z、W四种物质之间有如图所示的转化关系(部分物质未写全),且已知反应热之间的关系符合等式:△H=△H1+△H2,符合上述要求的X、Y可能是( )
①S、SO2 ②AlCl3、Al(OH)3 ③H2S、S ④Fe、FeCl2.

①S、SO2 ②AlCl3、Al(OH)3 ③H2S、S ④Fe、FeCl2.
| A. | ①②③ | B. | ②③ | C. | ②④ | D. | ①③④ |
15. 将等物质的量的金属Na、Mg、Al分别与100mL 2mol•L-1的盐酸反应,实验测得生成气体的体积V(已折合为标准状况)与时间t的关系如图所示,则下列说法错误的是( )
将等物质的量的金属Na、Mg、Al分别与100mL 2mol•L-1的盐酸反应,实验测得生成气体的体积V(已折合为标准状况)与时间t的关系如图所示,则下列说法错误的是( )
 将等物质的量的金属Na、Mg、Al分别与100mL 2mol•L-1的盐酸反应,实验测得生成气体的体积V(已折合为标准状况)与时间t的关系如图所示,则下列说法错误的是( )
将等物质的量的金属Na、Mg、Al分别与100mL 2mol•L-1的盐酸反应,实验测得生成气体的体积V(已折合为标准状况)与时间t的关系如图所示,则下列说法错误的是( )| A. | x=2.24 | B. | 钠的物质的量为0.2 mol | ||
| C. | 反应时,Na、Mg、Al均过量 | D. | 曲线b为Mg与盐酸反应的图象 |
2.下列化学反应的产物中,存在同分异构体的是( )
| A. | CH3CH2CHBrCH3与氢氧化钠的乙醇溶液反应 | |
| B. | 甲苯在催化剂作用下与Cl2发生苯环上的取代反应 | |
| C. | 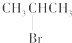 与NaOH的醇溶液共热反应 与NaOH的醇溶液共热反应 | |
| D. | 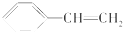 在催化剂存在下与H2完全加成 在催化剂存在下与H2完全加成 |
19.下列表达方式错误的是( )
| A. | 氢有三种核素:H、D、T | B. | S2-的结构示意图: | ||
| C. | 乙烯的结构简式:CH2CH2 | D. | CO2分子的结构式:O=C=O |
16.下列各组有机物只用一种试剂无法鉴别的是( )
| A. | 苯、甲苯、环己烷 | B. | 苯、苯酚、己烯 | ||
| C. | 乙醇、甲苯、硝基苯 | D. | 乙醇、乙醛、乙酸 |
17.2010年11月12日至27日广州成功举办了第16届亚运会.广州采取了一系列节能减排、改善环境质量的措施.下列说法错误的是( )
| A. | 发展核能发电,以减少火力发电带来的SO2和CO2的排放问题 | |
| B. | 发展低碳经济,利用太阳能、风能实现城市照明 | |
| C. | 推行“限塑令”,研发用二氧化碳合成聚碳酸酯类可降解塑料 | |
| D. | 使用填埋法或焚烧法处理未经分类的生活垃圾 |
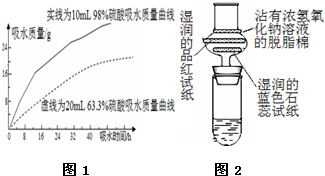 浓硫酸在高中化学实验中有着很重要的作用
浓硫酸在高中化学实验中有着很重要的作用