题目内容
10.下列事实与推论相符的是( )| 选项 | 实验事实 | 推论 |
| A | H2O的沸点比H2S的沸点高 | 非金属性:O>S |
| B | 盐酸的酸性比H2SO3的酸性强 | 非金属性:Cl>S |
| C | 钾与水的反应比钠与水的反应更剧烈 | 金属性:Na>K |
| D | HF的热稳定性比HCl的强 | 非金属性:F>Cl |
| A. | A | B. | B | C. | C | D. | D |
分析 比较非金属元素的非金属性强弱,可根据单质之间的置换反应、对应最高价氧化物的水化物的酸性、氢化物的稳定性等角度判断;比较金属元素的金属性强弱,可根据单质之间的置换反应、对应最高价氧化物的水化物的碱性、与水或酸反应的剧烈程度等角度判断.
解答 解:A.H2O的沸点比H2S的沸点高,是因为H2O分子间存在氢键,不能根据沸点高低判断非金属性强弱,故A错误;
B.最高价氧化物的水化物的酸性越强,盐酸和H2SO3不是最高价含氧酸,所以不能比较非金属性,故B错误;
C.金属与水反应越剧烈,则金属性越强,钾与水的反应比钠与水的反应更剧烈,则金属性:Na<K,故C错误;
D.非金属元素的氢化物越稳定,对应的非金属性越强,HF的热稳定性比HCl的强,则非金属性:F>Cl,故D正确.
故选D.
点评 本题考查非金属性和金属性的判断,题目难度不大,注意非金属性、金属性的递变规律以及比较非金属性、金属性的角度.

练习册系列答案
相关题目
6. 把一块镁铝合金投入到1mol/L酸中,待合金完全溶解后,再往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液的体积变化的关系如图所示,下列说法中错误的是( )
把一块镁铝合金投入到1mol/L酸中,待合金完全溶解后,再往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液的体积变化的关系如图所示,下列说法中错误的是( )
 把一块镁铝合金投入到1mol/L酸中,待合金完全溶解后,再往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液的体积变化的关系如图所示,下列说法中错误的是( )
把一块镁铝合金投入到1mol/L酸中,待合金完全溶解后,再往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液的体积变化的关系如图所示,下列说法中错误的是( )| A. | 盐酸的体积为80ml | B. | a的取值范围为0≤a<50 | ||
| C. | n(Mg2+)<0.025mol | D. | 当a值为30时,b值为0.01 |
5. 苯甲酸广泛用于医药、食品、染料、化工等领域.以下是实验室制备苯甲酸的一种方法.反应原理:
苯甲酸广泛用于医药、食品、染料、化工等领域.以下是实验室制备苯甲酸的一种方法.反应原理:
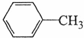 +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$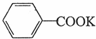 +2MnO2↓+KOH+H2O
+2MnO2↓+KOH+H2O
 +HCl→
+HCl→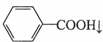 +KCl
+KCl
实验步骤:
①按图组装反应装置(冷凝水、夹持及加热装置未画出),并在三颈烧瓶中依次加入120mL水、9.4g高锰酸钾和3.0mL甲苯.
②将三颈烧瓶中的混合液体搅拌、加热至沸腾,直到甲苯完全反应.
③趁热过滤反应混合物.若滤液呈紫色,则需加入适量的亚硫酸氢钠溶液至紫色褪去后再过滤,用热水洗涤滤渣,洗涤液合并至滤液中.
④用冰水冷却滤液,然后用浓盐酸酸化,过滤,用少量冷水洗涤滤渣,得到苯甲酸粗产品,经重结晶得到精制的苯甲酸.
回答下列问题:
(1)三颈烧瓶所盛液体体积通常占其容积的1/3~2/3,则本实验应选择的三颈烧瓶规格为B(填字母序号).A.100mL B.250mL C.500mL D.1000mL
(2)判断甲苯己完全反应的现象是三颈烧瓶内溶液不分层、回流液不再出现油珠.
(3)实验步骤④中,用少量冷水而不用热水洗涤滤渣的目的是减少苯甲酸因溶解造成的损失;苯甲酸粗产品除了可用重结晶法精制外,还可用升华法.
(4)写出碱性高锰酸钾溶液与亚硫酸氢钠反应生成黑色沉淀的离子方程式2MnO4-+3HSO3-+OH-=2MnO2↓+3SO42-+2 H2O
(5)精制的苯甲酸纯度测定:称取1.220g样品,用稀乙醇溶解并配成100mL溶液,分别取25.00mL溶液,用0.1000mo1•L-1NaOH标准溶液滴定,三次滴定消耗NaOH溶液的体积分别为V1=24.70mL.V2=24.80mL.V3=25.80mL.
①配制溶液时用稀乙醇而不用蒸馏水作溶剂的原因是常温下苯甲酸微溶于水而易溶于乙醇.
②若用酚酞作指示剂,确定滴定终点的现象是加入最后一滴NaOH溶液,溶液由无色变为浅红色.
③产品的纯度为99.00%.
 苯甲酸广泛用于医药、食品、染料、化工等领域.以下是实验室制备苯甲酸的一种方法.反应原理:
苯甲酸广泛用于医药、食品、染料、化工等领域.以下是实验室制备苯甲酸的一种方法.反应原理: +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$ +2MnO2↓+KOH+H2O
+2MnO2↓+KOH+H2O +HCl→
+HCl→ +KCl
+KCl| 名称 | 相对分子质量 | 性状 | 熔点/℃ | 溶解度 | |
| 不溶 | 乙醇 | ||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -95 | 不溶 | 易溶 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4(100℃升华) | 25℃0.35g 80℃,2.7g | 易溶 |
①按图组装反应装置(冷凝水、夹持及加热装置未画出),并在三颈烧瓶中依次加入120mL水、9.4g高锰酸钾和3.0mL甲苯.
②将三颈烧瓶中的混合液体搅拌、加热至沸腾,直到甲苯完全反应.
③趁热过滤反应混合物.若滤液呈紫色,则需加入适量的亚硫酸氢钠溶液至紫色褪去后再过滤,用热水洗涤滤渣,洗涤液合并至滤液中.
④用冰水冷却滤液,然后用浓盐酸酸化,过滤,用少量冷水洗涤滤渣,得到苯甲酸粗产品,经重结晶得到精制的苯甲酸.
回答下列问题:
(1)三颈烧瓶所盛液体体积通常占其容积的1/3~2/3,则本实验应选择的三颈烧瓶规格为B(填字母序号).A.100mL B.250mL C.500mL D.1000mL
(2)判断甲苯己完全反应的现象是三颈烧瓶内溶液不分层、回流液不再出现油珠.
(3)实验步骤④中,用少量冷水而不用热水洗涤滤渣的目的是减少苯甲酸因溶解造成的损失;苯甲酸粗产品除了可用重结晶法精制外,还可用升华法.
(4)写出碱性高锰酸钾溶液与亚硫酸氢钠反应生成黑色沉淀的离子方程式2MnO4-+3HSO3-+OH-=2MnO2↓+3SO42-+2 H2O
(5)精制的苯甲酸纯度测定:称取1.220g样品,用稀乙醇溶解并配成100mL溶液,分别取25.00mL溶液,用0.1000mo1•L-1NaOH标准溶液滴定,三次滴定消耗NaOH溶液的体积分别为V1=24.70mL.V2=24.80mL.V3=25.80mL.
①配制溶液时用稀乙醇而不用蒸馏水作溶剂的原因是常温下苯甲酸微溶于水而易溶于乙醇.
②若用酚酞作指示剂,确定滴定终点的现象是加入最后一滴NaOH溶液,溶液由无色变为浅红色.
③产品的纯度为99.00%.
15. 将等物质的量的金属Na、Mg、Al分别与100mL 2mol•L-1的盐酸反应,实验测得生成气体的体积V(已折合为标准状况)与时间t的关系如图所示,则下列说法错误的是( )
将等物质的量的金属Na、Mg、Al分别与100mL 2mol•L-1的盐酸反应,实验测得生成气体的体积V(已折合为标准状况)与时间t的关系如图所示,则下列说法错误的是( )
 将等物质的量的金属Na、Mg、Al分别与100mL 2mol•L-1的盐酸反应,实验测得生成气体的体积V(已折合为标准状况)与时间t的关系如图所示,则下列说法错误的是( )
将等物质的量的金属Na、Mg、Al分别与100mL 2mol•L-1的盐酸反应,实验测得生成气体的体积V(已折合为标准状况)与时间t的关系如图所示,则下列说法错误的是( )| A. | x=2.24 | B. | 钠的物质的量为0.2 mol | ||
| C. | 反应时,Na、Mg、Al均过量 | D. | 曲线b为Mg与盐酸反应的图象 |
2.下列化学反应的产物中,存在同分异构体的是( )
| A. | CH3CH2CHBrCH3与氢氧化钠的乙醇溶液反应 | |
| B. | 甲苯在催化剂作用下与Cl2发生苯环上的取代反应 | |
| C. | 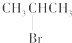 与NaOH的醇溶液共热反应 与NaOH的醇溶液共热反应 | |
| D. | 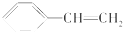 在催化剂存在下与H2完全加成 在催化剂存在下与H2完全加成 |
19.下列表达方式错误的是( )
| A. | 氢有三种核素:H、D、T | B. | S2-的结构示意图: | ||
| C. | 乙烯的结构简式:CH2CH2 | D. | CO2分子的结构式:O=C=O |
20.下列说法中,正确的是( )
| A. | 非金属元素之间形成的化合物一定是共价化合物 | |
| B. | 在气态单质分子中不一定存在着共价键 | |
| C. | 两个原子或多个原子之间的相互作用叫化学键 | |
| D. | 离子化合物中一定含有离子键,不存在共价键 |
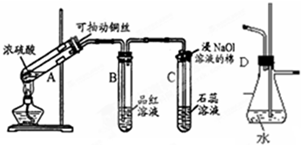 根据如图所示实验回答下列问题:
根据如图所示实验回答下列问题: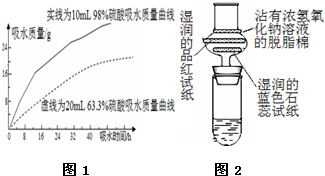 浓硫酸在高中化学实验中有着很重要的作用
浓硫酸在高中化学实验中有着很重要的作用