题目内容
【题目】请认真审题并作答:
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:_______________________。CaCN2中阴离子为CN22-,与CN22-互为等电子体的分子有N2O和CO2,由此可以推知CN22-的空间构型为__________________。
(2)三聚氰胺(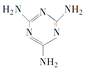 )俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸(
)俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸(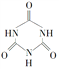 )后,三聚氰酸与三聚氰胺分子相互之间通过______________结合。在肾脏内易形成结石。
)后,三聚氰酸与三聚氰胺分子相互之间通过______________结合。在肾脏内易形成结石。
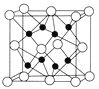
(3)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为_________。

(4)CaO晶体和NaCl晶体的晶格能分别为:CaO 3401kJ·mol-1、NaCl 786kJ·mol-1。导致两者晶格能差异的主要原因是________________。
【答案】 1s22s22p63s23p63d104s2或[Ar]3d104s2 直线形 分子间氢键 6 CaO晶体中Ca2+、O2-的带电量大于NaCl晶体中Na+、Cl-的带电量
【解析】(1)与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子是锌,根据构造原理,基态的锌原子核外电子排布式为1s22s22p63s23p63d104s2或[Ar]3d104s2;等电子体具有相同的价电子数、原子总数,结构相似,二氧化碳分子是直线形,所以CN22-离子的空间构型是直线形,故答案为:1s22s22p63s23p63d104s2或[Ar]3d104s2;直线形;
(2)三聚氰酸与三聚氰胺分子相互之间能形成氢键,所以是通过分子间氢键结合,在肾脏内易形成结石.故答案为:分子间氢键;
(3)以钙离子为中心,沿X、Y、Z三轴进行切割,上下左右前后,结合图片知,钙离子的配位数是6,故答案为:6;
(4)晶格能大小与离子带电量成正比,CaO晶体中Ca2+、O2-的带电量大于NaCl晶体中Na+、Cl-的带电量,导致的氧化钙晶格能大于氯化钠的晶格能,故答案为:CaO晶体中Ca2+、O2-的带电量大于NaCl晶体中Na+、Cl-的带电量。

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案