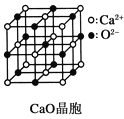
题目内容
【题目】下列各组说法一定正确的是( )
A.强电解质:盐酸、氢氧化钡、明矾
B.纯净物:冰水混合物;含氧40%的氧化镁
C.有单质参加和单质生成的化学反应一定是氧化还原反应
D.同位素:H2、D2、T2
【答案】B
【解析】解:A.盐酸是HCl的水溶液,是混合物,既不是电解质也不是非电解质,故A错误;
B.冰水混合物都是由水分子构成的,属于纯净物,含氧40%的氧化镁,也是纯净物,故B正确;
C.同素异形体之间的转化,化合价都是0,没有变化,不是氧化还原反应,故C错误;
D.H2、D2、T2是分子,不是核素,因此不是同位素,故D错误;
故选B.

【题目】下列图示与对应的叙述不相符合的是

A.图甲表示燃料燃烧反应的能量变化
B.图乙表示酶催化反应的反应速率随反应温度的变化
C.图丙表示弱电解质在水中建立电离平衡的过程
D.图丁表示强碱滴定强酸的滴定曲线
【题目】(1)已知25 ℃时有关弱酸的电离平衡常数:
弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
① 同温度下,等pH值的a. NaHCO3、b. NaCN、c.Na2CO3溶液的物质的量浓度由大到小的顺序为__________(填序号)。
② 25 ℃时,将20mL 0.1mol/LCH3COOH溶液和20mL0.1mol/LHSCN溶液分别与20ml0.1mol/L NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:
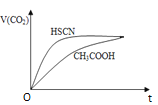
反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是:________反应结束后所得两溶液中,c(SCN-)________c(CH3COO-)(填“> ”、“< ”或“= ”)
③ 若保持温度不变,在醋酸溶液中加入一定量氨气,下列量会变小的是______(填序号)。
a.c(CH3COO-) b.c(H+) c.Kw d.醋酸电离平衡常数
(2)煤燃烧产生的烟气也含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。己知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867.0kJ mol-1
2NO2(g)![]() N2O4(g) △H=-56.9kJ mol-1
N2O4(g) △H=-56.9kJ mol-1
H2O(g)=H2O(l) △H=-44.0kJ mol-1
写出CH4催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(l)的热化学方程式_________
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50mL 2mol/L的氯化铜溶液的装置示意图:请回答下列问题:
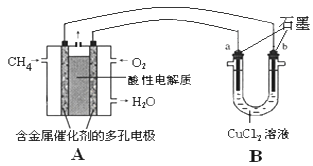
①甲烷燃料电池的负极反应式是____________
②当A中消耗0.15mol氧气时.B 中____极增重_______g。